15.下列粒子中,其最外层与最里层的电子数之和等于次外层电子数的是( )
| A. | S | B. | Mg | C. | Cl | D. | Be |
14.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
12.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由.实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)

请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)
10.C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2.将2.00g C跟16.0g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g.下列说法错误的是( )
| A. | 反应后的固体混合物中还含有碳 | |
| B. | 反应后的固体混合物总质量为14.4 g | |
| C. | 反应后的固体混合物中单质Cu的质量为12.8 g | |
| D. | 反应后的固体混合物中氧化物的物质的量为0.05 mol |
9.关于下列各图的叙述,正确的是( )
| A. |  表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 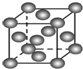 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. |  装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
8.下列解释过程或事实的方程式不正确的是( )
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ | |
| C. | 红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O=Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )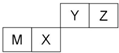

| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
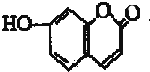
6.某有机物结构简式如图所示,下列有关该有机物叙述正确的是( )
0 167056 167064 167070 167074 167080 167082 167086 167092 167094 167100 167106 167110 167112 167116 167122 167124 167130 167134 167136 167140 167142 167146 167148 167150 167151 167152 167154 167155 167156 167158 167160 167164 167166 167170 167172 167176 167182 167184 167190 167194 167196 167200 167206 167212 167214 167220 167224 167226 167232 167236 167242 167250 203614

| A. | 该有机物分子式为C9H8O3 | |
| B. | 该有机物最多可以和4mol氢气发生反应 | |
| C. | 1 mo1该有机物与溴水反应,最多消耗2 mol Br2 | |
| D. | 1 mol该有机物最多与2 mol NaOH反应 |
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题:
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题: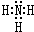 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.