题目内容
9.关于下列各图的叙述,正确的是( )| A. | 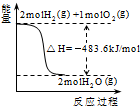 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 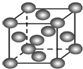 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 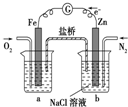 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
分析 A、燃烧热是1mol可燃物完全反应生成稳定氧化物放出的热量;
B、依据铜的晶体结构特征是面心立方最密堆积分析判断;
C、依据原电池原理分析,通氧气的电极为正极得到电子发生还原反应生成氢氧根离子;
D、电镀原理是镀层金属做阳极与电源正极相连,待镀金属做阴极与电源负极相连,含镀层金属离子的电解质溶液.
解答 解:A、1mol可燃物完全燃烧生成稳定氧化物放出的热量,由图可知焓变是2mol氢气燃烧生成气态水放出的热量,不符合燃烧热概念,故A错误;
B、图中表示的是面心立方最密堆积属于Cu型,即铜原子形成晶体时采用的堆积方式,故B正确;
C、烧杯a中通氧气的电极为正极得到电子发生还原反应生成氢氧根离子,溶液pH增大,故C错误;
D、镀层金属做阳极与电源正极相连,待镀金属做阴极与电源负极相连,故D错误;
故选B.
点评 本题考查了化学反应热概念的分析判断,晶体结构的理解应用,原电池电解池原理分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
19.两种物质不论以什么质量比混合,只要混合物的质量一定,充分燃烧时产生的水的量总为定值,这组混合物是( )
| A. | 乙炔和丁炔 | B. | 乙烷和丁烷 | C. | 苯和甲苯 | D. | 乙炔和苯 |
17.若X+酸?盐+水,则X不可能属于( )
| A. | 氧化物 | B. | 单质 | C. | 碱 | D. | 电解质 |
4.对于原电池的电极名称,叙述错误的是( )
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 活泼性较强的金属为负极 | D. | 电流表偏向的为正极 |
14.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
1.下列推断不正确的是( )
| A. | 稳定性:HF>HCl>HBr>HI | B. | 氧化性:I2>Br2>Cl2 | ||
| C. | 沸点:H2O>NH3 | D. | 还原性:HI>HBr>HCl>HF |
18.下列物质中,属于非电解质的是( )
| A. | 蔗糖 | B. | 金属镁 | C. | 氧气 | D. | 氧化钠 |
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
 .
.