题目内容
13. A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:(1)A、B、C的第一电离能由小到大的顺序为C<O<N.
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足8电子,其结构式为N≡C-C≡N,1mol该分子中含有π键的数目为4NA.
(3)基态D原子的外围电子排布式为3d54s1.DO2Cl2熔点:-96,.5℃,沸点:117℃,则固态DO2Cl2属于分子晶体.
(4)E的氢化物的晶胞结构如图所示,其化学式是CuH.若该晶胞的边长为acm,NA代表阿伏伽德罗常数的数值,则该晶体的密度表达式为$\frac{4×65}{{a}^{3}{N}_{A}}$g/cm3.
分析 A、B、C是短周期非金属元素,核电荷数依次增大,C是地壳中含量最多的元素,则C是O元素;A原子的外围电子排布式为ns2np2,则A处于ⅣA族,A的原子序数小于C,所以A是C元素,B原子序数介于碳、氧之间,则B是N元素;元素D、E都位于第四周期,其中E的核电荷数为29,则E是Cu元素,D原子的核外未成对电子数在同周期中是最多的,外围电子排布为3d54s1,则D是Cr元素,据此解答.
解答 解:A、B、C是短周期非金属元素,核电荷数依次增大,C是地壳中含量最多的元素,则C是O元素;A原子的外围电子排布式为ns2np2,则A处于ⅣA族,A的原子序数小于C,所以A是C元素,B原子序数介于碳、氧之间,则B是N元素;元素D、E都位于第四周期,其中E的核电荷数为29,则E是Cu元素,D原子的核外未成对电子数在同周期中是最多的,外围电子排布为3d54s1,则D是Cr元素.
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,其第一电离能高于O氧元素,故第一电离能C<O<N,故答案为:C<O<N;
(2)(CN)2每个原子最外层电子数均满足八电子,其结构式为:N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,1mol该分子中含有π键的数目为4NA,故答案为:N≡C-C≡N;4NA;
(3)D处于第四周期,D原子核外未成对电子数在同周期中最多,则其外围电子排布为3d54s1,CrO2Cl2熔点:-96,.5℃,沸点:117℃,熔沸点较低,则固态CrO2Cl2属于分子晶体,
故答案为:3d54s1;分子;
(4)由晶胞结构可知,晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球数目为4,故该晶体化学式为CuH;晶胞质量为4×$\frac{65}{{N}_{A}}$g,该晶胞的边长为acm,晶胞体积为(a cm)3,则该晶体的密度表达式为 4×$\frac{65}{{N}_{A}}$g÷(a cm)3=$\frac{4×65}{{a}^{3}{N}_{A}}$g/cm3,故答案为:CuH;$\frac{4×65}{{a}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及电离能、核外电子排布、化学键、晶体类型与性质、晶胞计算等,注意理解同周期第一电离能发生异常情况,难度不大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
| A. | 新制农药元素 | B. | 制催化剂元素 | ||
| C. | 制半导体元素 | D. | 制耐高温合金元素 |
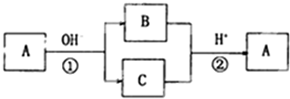
a.X元素为Al;
b.反应①和反应②互为可逆反应;
c.A可能是S或Cl2;
d.反应①和反应②一定是氧化还原反应.
| A. | a和b | B. | c和d | C. | a、b、c、d | D. | b、c、d |
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 甲醇燃料电池(KOH作电解质溶液)的负极反应式:CH3OH-6e+H2O=CO2+6H+ | |
| C. | 红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O=Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: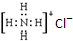 | |
| D. | Fe原子的结构示意图: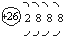 |
| A. | 含有非极性键的分子一定是非极性分子 | |
| B. | 非极性分子中一定含有非极性键 | |
| C. | 由极性键形成的双原子分子一定是极性分子 | |
| D. | 键的极性与分子的极性无关 |
| A. | 灼热的炭与CO2反应 | B. | 铝与稀盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷与O2的燃烧反应 |
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |