5.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
4.用稀盐酸预处理强酸型阳离子交换树脂,使之变为HR,再用蒸馏水洗涤至中性,然后用该树脂软化100mL含0.001molMg2+的中性溶液,使Mg2+完全被树脂所交换,再用100mL蒸馏水洗涤树脂.将交换液和洗涤液收集到一起,该混合液的pH为( )
| A. | 2.0 | B. | 2.3 | C. | 3.0 | D. | 7.0 |
3.下列实验或叙述不符合绿色化学理念的是( )
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 采用银作催化剂,用乙烯和氧气反应制取环氧乙烷(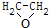 ) ) | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和稀HNO3反应制取Cu(NO3)2 |
2.下列实验操作中错误的是( )
| A. | 蒸馏操作时,先得到的少量液体可能会与器壁等接触而含杂质较多,可以弃掉 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏,为了更好的控制温度,用水浴加热比直接加热要好 |
1.下列说法中错误的是( )
| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
20.(Ⅰ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K==$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH-,KSP=c(Cu2+)•[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于5.
(2)要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6.
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K==$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH-,KSP=c(Cu2+)•[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于5.
(2)要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6.
18.下列各组物质之间的反应,反应产物一定为纯净物的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
0 166967 166975 166981 166985 166991 166993 166997 167003 167005 167011 167017 167021 167023 167027 167033 167035 167041 167045 167047 167051 167053 167057 167059 167061 167062 167063 167065 167066 167067 167069 167071 167075 167077 167081 167083 167087 167093 167095 167101 167105 167107 167111 167117 167123 167125 167131 167135 167137 167143 167147 167153 167161 203614
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小,且Y是地壳中含量最高的金属元素 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
 或
或 .
.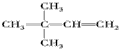 、
、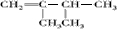 、
、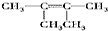 .
.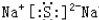 .
.