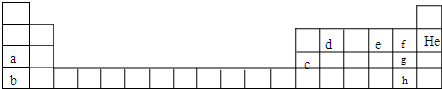
题目内容
1.下列说法中错误的是( )| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
分析 A、半导体材料的元素在元素周期表金属与非金属分界线附近能找到;
B、氢键是分子间作用力,不是化学键;
C、元素原子核外电子排布周期性变化的必然结果是元素周期律;
D、元素周期表是元素周期律的具体表现形式.
解答 解:A、半导体材料的元素在元素周期表金属与非金属分界线附近能找到,故A正确;
B、氢键是分子间作用力,不是化学键,故B错误;
C、元素原子核外电子排布周期性变化的必然结果是元素周期律,故C正确;
D、元素周期表是元素周期律的具体表现形式,揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一,故D正确;
故选B.
点评 本题考查结构性质位置关系应用,侧重对基础知识的巩固,元素周期律的实质及理解是解题关键,难度不大.

练习册系列答案
相关题目
12.下列物质中含有共价键的离子化合物是( )
| A. | BaCl2 | B. | H2O | C. | HCl | D. | Ba(OH)2 |
9.下列各组元素原子中,金属性依次增强的是( )
| A. | Na,Mg,Al | B. | N,O,F | C. | Li,Na,K | D. | I,Br,Cl |
16.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小,且Y是地壳中含量最高的金属元素 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
6.在下列各溶液中,离子可能大量共存的是( )
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、H+、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
13.核素${\;}_{6}^{14}$C可用于推算出生物死亡的年代.关于${\;}_{6}^{14}$C有关叙述不正确的是( )
| A. | 是一种核素 | B. | 原子核内有8个中子 | ||
| C. | 与${\;}_{6}^{12}$C互为同位素 | D. | 比${\;}_{6}^{13}$C少一个电子 |
11.下列各物质中,互为同系物的是( )
| A. | 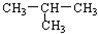 与CH3-CH2-CH2-CH3 与CH3-CH2-CH2-CH3 | B. | 醋酸和十八酸 | ||
| C. | 乙二醇和甘油 | D. | 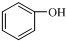 和 和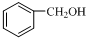 |
 小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.
小明同学设计了如图所示装置来探究铜跟浓硫酸的反应.