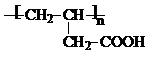题目内容
5.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
分析 A、平衡常数只受温度影响,从平衡移动的方向判断平衡常数的变化;
B、可逆反应中,加入一种反应物,平衡向正方向移动,以此判断转化率变化;
C、反应达到平衡时,不同物质表示的正、逆反应速率之比等于化学计量数之比;
D、催化剂能加快反应速率,但不影响平衡的移动.
解答 解:A、正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故A错误;
B、增大一个反应物浓度,其它反应物转化率增大,故B错误;
C、2v正(NO)=v逆(N2)说明单位时间内消耗NO和N2的物质的量比为1:2时,等于化学计量数之比,反应到达平衡,故C正确.
D、使用催化剂平衡不移动,废气中氮氧化物的转化率不变,故D错误;
故选C.
点评 本题考查外界条件对化学反应速率的影响、平衡状态的判断等,做题时注意平衡常数的变化以及平衡状态的判断方法,题目难度不大.

练习册系列答案
相关题目
16.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
| A. | HI>HCl>NH3 | B. | HCl>NH3>HI | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
13.同一周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 元素原子得电子能力:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
20.(Ⅰ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K==$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH-,KSP=c(Cu2+)•[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于5.
(2)要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6.
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K==$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH-,KSP=c(Cu2+)•[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于5.
(2)要使0.2mol•L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6.
10.用已知浓度的盐酸来测定某Na2CO3溶液的浓度时,若配制Na2CO3溶液时所用Na2CO3中分别含有:①NaOH ②NaCl ③NaHCO3④K2CO3杂质,所测结果偏低的是( )
| A. | ① | B. | 仅② | C. | ①②③ | D. | ②③④ |

 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.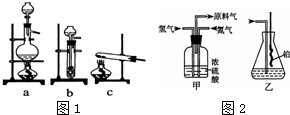
 B的分子式为C4H8O3
B的分子式为C4H8O3