18.下列物质的用途利用了其还原性的是( )
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用NaHCO3治疗胃酸过多 | D. | 用Na2SiO3溶液制备木材防火剂 |
16.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.
(1)O2-的离子结构示意图为 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
(1)O2-的离子结构示意图为
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
15. 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:
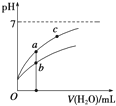
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如如图所示,下列说法正确的是( )
 25℃时某些弱酸的电离平衡常数如表所示:
25℃时某些弱酸的电离平衡常数如表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({P}^{-})}{c(HP).c(O{H}^{-})}$相等(HP代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO${\;}_{3}^{2-}$ |
14.下列判断正确的是( )
| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol ${\;}_{8}^{16}$OD- 离子含有的质子、中子数均为1.0NA | |
| B. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| C. | 3.6 g石墨中,含有共价键数为0.3NA | |
| D. | 标准状况下,4.48 L己烷含有的分子数为0.2NA |
12.生活中处处有化学,下列表述不正确的是( )
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 碳酸氢钠可作胃酸的中和剂 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
11.下表是3种物质的溶解度(20℃),下列说法中不正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
| A. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| B. | 已知MgCO3的Ksp=6.82×10-6 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 mol2•L-2 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液 | |
| D. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O |
10.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液显碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等.则下列说法正确的是( )
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
9.锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为V2O5+xLi═LixV2O5,下列说法不正确的是( )
0 166914 166922 166928 166932 166938 166940 166944 166950 166952 166958 166964 166968 166970 166974 166980 166982 166988 166992 166994 166998 167000 167004 167006 167008 167009 167010 167012 167013 167014 167016 167018 167022 167024 167028 167030 167034 167040 167042 167048 167052 167054 167058 167064 167070 167072 167078 167082 167084 167090 167094 167100 167108 203614
| A. | 向外供电时,锂离子向负极移动 | |
| B. | 负极上反应的物质是锂,正极上反应的物质是V2O5 | |
| C. | 正极的电极反应为:V2O5+xe-+xLi+═LixV2O5 | |
| D. | 负极的电极反应为:xLi-xe-═xLi+ |



