题目内容
14.下列判断正确的是( )| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
分析 A.二氧化碳和碳酸根离子、水生成碳酸氢根离子,碳酸能和硅酸根离子反应生成硅酸;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.向硫酸铝铵中滴加NaOH,NaOH先和铝离子反应后和铵根离子反应,当NaOH足量时,二者都反应,生成一水合氨和偏铝酸根离子;
D.Fe2+、SO2都能被酸性高锰酸钾溶液氧化而使其褪色.
解答 解:A.二氧化碳和碳酸根离子、水生成碳酸氢根离子,碳酸能和硅酸根离子反应生成硅酸沉淀,所以不能共存,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,一水合氨是弱碱抑制水电离,醋酸钠是强碱弱酸盐,醋酸根离子水解而促进水电离,所以二者溶液水电离程度不同,故B错误;
C.向硫酸铝铵中滴加NaOH,NaOH先和铝离子反应后和铵根离子反应,当NaOH足量时,二者都反应,生成一水合氨和偏铝酸根离子,离子方程式为NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O,故C正确;
D.Fe2+、SO2都能被酸性高锰酸钾溶液氧化而使其褪色,亚铁离子和二氧化硫都体现还原性,故D错误;
故选C.
点评 本题考查离子共存、氧化还原反应、离子方程式的书写等知识点,综合性较强,为高考高频点,明确物质、离子性质是解本题关键,注意C中离子反应先后顺序,注意二氧化硫漂白性和还原性的区别.

练习册系列答案
相关题目
4.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol $\stackrel{+5}{I}$被氧化 |
5.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 12克金刚石中含有的C-C键数目为为4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4L乙烯与丙烯的混合物中含有的分子数目为NA | |
| D. | 常温常压下,Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4NA |
9.锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为V2O5+xLi═LixV2O5,下列说法不正确的是( )
| A. | 向外供电时,锂离子向负极移动 | |
| B. | 负极上反应的物质是锂,正极上反应的物质是V2O5 | |
| C. | 正极的电极反应为:V2O5+xe-+xLi+═LixV2O5 | |
| D. | 负极的电极反应为:xLi-xe-═xLi+ |
19.下列解释事实的方程式不正确的是( )
| A. | 铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| B. | 工业进行“氮的固定”:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | 铅蓄电池充电时阴极反应:PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| D. | 用铜和稀硝酸制备硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2 |
6.已知某强酸性的溶液中存在大量的NO3-,下列有关该溶液中还存在的物质叙述正确的是( )
| A. | 铝元素能以Al3+或AlO2-的形式存在 | |
| B. | 铁元素能以Fe2+和Fe3+的形式共存 | |
| C. | 硫元素主要以SO42-的形式存在 | |
| D. | 氯元素能以Cl-或ClO-的形式存在 |
3.如图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
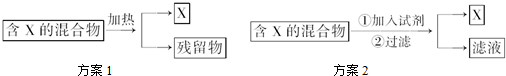

| A. | 可以选用方案1分离碳酸氢钠中含有的氯化铵 | |
| B. | 方案1中残留物可以受热不易挥发 | |
| C. | 方案2中加入的试剂一定能够与除X外的物质发生化学反应 | |
| D. | 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3. |
4.下列有关氨及氨水的说法中,正确的是( )
| A. | NH3是10电子分子,具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | NH3•H2O是混合物 |
 写出B的化学式Fe2O3
写出B的化学式Fe2O3