题目内容
9.锂钒氧化物电池的能量密度远远超过其他材料电池,电池总反应式为V2O5+xLi═LixV2O5,下列说法不正确的是( )| A. | 向外供电时,锂离子向负极移动 | |
| B. | 负极上反应的物质是锂,正极上反应的物质是V2O5 | |
| C. | 正极的电极反应为:V2O5+xe-+xLi+═LixV2O5 | |
| D. | 负极的电极反应为:xLi-xe-═xLi+ |
分析 该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,电极反应式为xLi-xe-═xLi+,正极反应式为V2O5+xe-+xLi+═LixV2O5,放电时电解质内部阳离子向正极移动.
解答 解:该反应中Li元素化合价由0价变为+1价,V元素化合价由+5价变为+$\frac{10-x}{2}$价,放电时,Li是负极,正极上反应的物质是V2O5,
A.放电时电解质内部阳离子向正极移动,所以锂离子向正极移动,故A错误;
B.得电子化合价降低的在正极上反应、失电子化合价升高的在负极上反应,根据元素化合价变化知,负极上反应的物质是锂,正极上反应的物质是V2O5,故B正确;
C.正极上V2O5发生还原反应,反应式为V2O5+xe-+xLi+═LixV2O5,故C正确;
D.负极上Li失电子发生氧化反应,电极反应式为xLi-xe-═xLi+,故D正确;
故选A.
点评 本题考查化学电源新型电池,为高考高频点,明确元素化合价变化与电极反应关系是解本题关键,难点是电极反应式的书写.

练习册系列答案
相关题目
20.下列比较中不正确的是( )
| A. | 离子半径:Cl->F->Na+ | B. | 热稳定性:HCl>H2S>HF | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 熔点:金刚石>晶体硅>CO2 |
17.下列说法不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,一段时间后,溶液充满试管
②向FeCl3溶液中加入Mg粉,有气泡产生
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3.
①将盛有二氧化氮气体的试管倒立在水中,一段时间后,溶液充满试管
②向FeCl3溶液中加入Mg粉,有气泡产生
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3.
| A. | 仅①③④ | B. | 仅②③④ | C. | 仅①③④⑤ | D. | 仅①②④⑤ |
4.下列有关实验的操作与现象描述及相关结论正确的是( )
| A. | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去,证明生成的气体全部是乙烯 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 某些强氧化剂如氯酸钾、硝酸钾等或其混合物不能研磨,否则可能引起爆炸 | |
| D. | 取5mL0.1mol•L-1KI溶液,滴加0.1mol•L-1FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡后静置,取上层溶液加KSCN溶液,无明显现象 |
14.下列判断正确的是( )
| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
1.如图为锌铜显示原电池装置图,下列说法不正确( )


| A. | 电子由Zn极流向Cu极 | |
| B. | 该装置的总反应Zn+Cu2+═Zn2++Cu | |
| C. | 一段时间后,A池带正电荷,B池带负电荷 | |
| D. | 取出盐桥,电流计指针不再偏转 |
18.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙烷>乙二醇>乙醇 | |
| B. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 | |
| C. | 油脂和蛋白质均为能发生水解反应的高分子化合物 | |
| D. | 聚碳酸酯 中含有 中含有 结构 结构 |
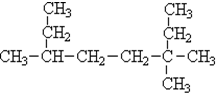

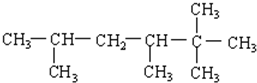
 ,反应类型为加聚反应.
,反应类型为加聚反应.