题目内容
11.下表是3种物质的溶解度(20℃),下列说法中不正确的是( )| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
| A. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| B. | 已知MgCO3的Ksp=6.82×10-6 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 mol2•L-2 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液 | |
| D. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O |
分析 A、依据盐类水解原理分析即可;
B、此温度下,碳酸镁的饱和溶液中存在c(Mg2+)•c(CO32-)=6.82×10-6,据此解答即;
C、溶解度:Mg(OH)2<MgCO3,故除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH;
D、用石灰水处理含有Mg2+和HCO3-的硬水,依据元素守恒解答即可.
解答 解:A、MgCl2+2H2O?Mg(OH)2+2HCl,加热MgCl2溶液,平衡向右移动,最后打破平衡,蒸干后得到Mg(OH)2,灼烧Mg(OH)2,Mg(OH)2分解得到MgO,MgCO3+2H2O?Mg(OH)2+H2CO3,加热MgCO3溶液,平衡向右移动,最后打破平衡,蒸干后得到Mg(OH)2,灼烧后,也得到MgO,故三者最终的固体产物相同,故A正确;
B、c(Mg2+)•c(CO32-)=6.82×10-6,但不一定都有c(Mg2+)=c(CO32-),故B错误;
C、溶解度:Mg(OH)2<MgCO3,故除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH,故C正确;
D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O,故D正确;
故选B.
点评 主要考查对盐水解的影响因素,水解方程式,盐类水解判断溶液酸碱性或比较溶液pH值的大小,盐类水解的定义 等考点的理解,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
2.下列说法中正确的是( )
| A. | 分子式为C4H9Cl的物质一共有4种结构 | |
| B. | 可以用酸性KMnO4溶液除去甲烷中的乙烯 | |
| C. | 2,2-二甲基丙烷中所有碳原子在同一平面上 | |
| D. | CH3-CH=CH-CH3与HCl发生加成反应,产物有两种 |
19.运用相关化学知识进行判断,下列结论正确的是( )
| A. | PM2.5表示每立方米空气中直径小于或等于2.5μm的颗粒物的含量,PM2.5值越高,大气污染越严重,因此由PM2.5引起的雾霾一定属于胶体 | |
| B. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| C. | 对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 | |
| D. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
6.下列说法正确的是( )
| A. | 按系统命名法,有机物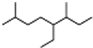 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 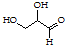 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次增加 | |
| D. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯 |
16.非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛.
(1)O2-的离子结构示意图为 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O=SO42-+3H++2Cl-.
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
(1)O2-的离子结构示意图为
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例ClO2、O3、Cl2(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子之间能形成氢键而乙烷不能;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是Fe(FeCl3)能催化苯与氯气的反应.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于1:2
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物.已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体.该气体被溴水全部吸收后,溴水增重2.8g.请写出该水解反应方程式MgC+2H2O=Mg(OH)2+C2H4.
3.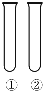 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )
 下列①②对应的试剂(或条件)不能完成实验目的是( )
下列①②对应的试剂(或条件)不能完成实验目的是( )| 实验目的 | 试剂(或条件) | |
| A | 温度对Na2S2O3与H2SO4反应速率的影响 | ①热水浴②冷水浴 |
| B | 用Na块检验乙醇分子存在不同与烃分子里的氢原子 | ①乙醇②煤油 |
| C | 用酸化的AgNO3溶液检验来自水中Cl-能否蒸馏除去 | ①自来水②蒸馏水 |
| D | 用溴水检验苯的同系物种取代基对苯活性有影响 | ①苯②甲苯 |
| A. | A | B. | B | C. | C | D. | D |
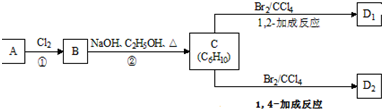
1.有机化合物A只由C、H两种元素组成且能使溴水褪色,其相对分子质量为28,A、B、C、D、E有如下关系: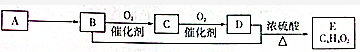
则下列判断错误的是( )

则下列判断错误的是( )
| A. | B中含有的官能团为羟基 | B. | 可用碳酸钠溶液区别B、D | ||
| C. | D中含有C═O键,E的名称为乙酸乙酯 | D. | B+D→E反应的装置如图 |
 .
.