10.下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
请按要求回答下列问题(用化学用语回答):
(1)写出③的原子结构示意图: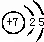 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.
(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程: .
.
(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
(1)写出③的原子结构示意图:
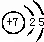 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程:
 .
.(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
9.某元素R的最高价氧化物对应的水化物是HnRO2n,则在气态氢化物中R元素的化合价是( )
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
8.以下各微粒中,所有原子都满足最外层为8电子结构的是( )
| A. | H3O+ | B. | BF3 | C. | CO2 | D. | PCl5 |
7.下列对化学知识概括合理的是( )
| A. | 金属氧化物都是强电解质 | |
| B. | 一种金属元素只能有一种氧化物 | |
| C. | 在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 | |
| D. | 能与金属铝反应产生氢气的溶液一定是酸溶液 |
6.下列物质中既含有共价键又含离子键的化合物是( )
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
5.下列四位同学对“NH4Cl”的认识中,不正确的是( )
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
4.下列有关原子核外电子排布的说法正确的是( )
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
3.下列微粒与Na+具有相同的质子数和电子数的是( )
| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
2.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
1.下列关于卤素的变化规律不正确的是( )
0 166883 166891 166897 166901 166907 166909 166913 166919 166921 166927 166933 166937 166939 166943 166949 166951 166957 166961 166963 166967 166969 166973 166975 166977 166978 166979 166981 166982 166983 166985 166987 166991 166993 166997 166999 167003 167009 167011 167017 167021 167023 167027 167033 167039 167041 167047 167051 167053 167059 167063 167069 167077 203614
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的沸点:HCl>HBr>HI | ||
| C. | 酸性:HF<HCl<HBr<HI | D. | 酸性:HClO4>HBrO4>HIO4 |