题目内容
3.下列微粒与Na+具有相同的质子数和电子数的是( )| A. | Ne | B. | NH4+ | C. | F- | D. | H2O |
分析 Na+中质子数是11个,电子数是10个,依此进行判断.
解答 解:Na+中质子数是11个,电子数是10个.
A.Ne中质子数是10,电子数是10,所以和钠离子中质子数不同,电子数相同,故A错误;
B.NH4+质子数是11,电子数是10,所以和钠离子中质子数和电子数都相同,故B正确;
C.F-中质子数是9,电子数是10,所以和钠离子中质子数不同,电子数相同,故C错误;
D.H2O中质子数是10,电子数是10,所以和钠离子中质子数不同,电子数相同,故D错误.
故选B.
点评 本题考查分子和离子中质子数和电子数的计算,难度不大.要注意阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数.

练习册系列答案
相关题目
11.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示,下列说法正确的是( )
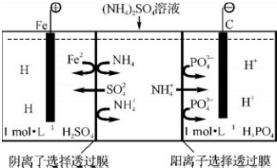

| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
14.下列离子方程式中正确的是( )
| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
18.某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )


| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
8.以下各微粒中,所有原子都满足最外层为8电子结构的是( )
| A. | H3O+ | B. | BF3 | C. | CO2 | D. | PCl5 |
15.下列说法中正确的是( )
| A. | C2H6与C4H10一定互为同系物 | |
| B. | C2H4与C4H8一定互为同系物 | |
| C. | 分子量相同的两种物质一定互为同分异构体 | |
| D. | 分子中含有羟基的物质一定是醇 |
12.从化学键角度分析,下列属于化学变化的是( )
| A. | 蔗糖溶解 | B. | H2SO4溶于水 | C. | NH3溶于水 | D. | 氯化镁受热熔化 |
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.