题目内容
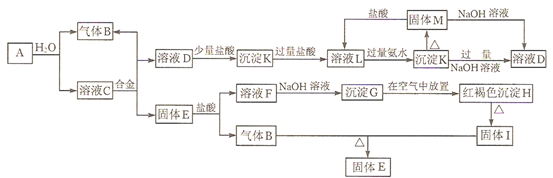
10.下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
(1)写出③的原子结构示意图:
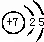 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.(2)7种元素中,原子半径最小的是:H.
(3)用电子式表示元素②与④最高价化合物的形成过程:
 .
.(4)元素⑤和元素⑥最高价氧化物的水化物碱性由强到弱关系为:NaOH>Al(OH)3.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
(6)用一个化学方程式证明④的单质的活泼性强于③的单质:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,
(1)元素③为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为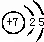 ,③与①所形成的化合物为氨气,氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构,结构式为:
,③与①所形成的化合物为氨气,氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构,结构式为: ,故答案为:
,故答案为: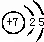 ;
; ;
;
(2)H原子只有1个电子层,其原子半径最小,故答案为:H;
(3)②与④最高价化合物为CO2,二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为 ,
,
故答案为: ;
;
(4)金属性Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH>Al(OH)3,故答案为:NaOH>Al(OH)3;
(5)元素O的氢化物为水,氯气与水反应生成盐酸和次氯酸,氧化物不能拆,单质不能拆,此反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(6)③、④都是较活泼的非金属元素,反应4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O中氧化剂是氧气、氧化产物是氮气,说明氧气的氧化性大于氮气,则非金属性:N<O,
故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
点评 本题考查元素的推断以及原子结构、物质的性质等知识,题目难度不大,本题注意有关电子式和反应的离子的方程方程式的书写,加强化学用语的学习.

练习册系列答案
相关题目
18.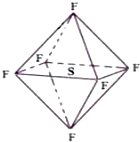 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
 六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( )| A. | 六氟化硫易燃烧生成二氧化硫 | |
| B. | 六氟化硫中各原子均达到8电子稳定结构 | |
| C. | 六氟化硫分子中的S-F键都是σ键,且键长、键能都相等 | |
| D. | 六氟化硫分子是极性分子 |
18.某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,下列说法不正确的是( )


| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
5.下列四位同学对“NH4Cl”的认识中,不正确的是( )
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
15.下列说法中正确的是( )
| A. | C2H6与C4H10一定互为同系物 | |
| B. | C2H4与C4H8一定互为同系物 | |
| C. | 分子量相同的两种物质一定互为同分异构体 | |
| D. | 分子中含有羟基的物质一定是醇 |
2.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |