题目内容
6.下列物质中既含有共价键又含离子键的化合物是( )| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属元素、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,铵根离子和酸根离子之间存在离子键.
解答 解:A.NaCl中钠离子和氯离子之间只存在离子键,故A错误;
B.氧化铝中铝离子和氧离子之间只存在离子键,故B错误;
C.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故C正确;
D.甲烷分子中C-H原子之间存在共价键,故D错误.
故选C.
点评 本题考查离子键和共价键,侧重考查基本概念,明确离子键和共价键的区别即可解答,注意不能根据所含元素判断化学键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.室温时,将盛有NH4HCO3烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸溶液,反应剧烈,大烧杯中的醋酸逐渐凝固(乙酸的熔点:16.6℃),下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
1.下列关于卤素的变化规律不正确的是( )
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的沸点:HCl>HBr>HI | ||
| C. | 酸性:HF<HCl<HBr<HI | D. | 酸性:HClO4>HBrO4>HIO4 |
18.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
| A. | CH3-CH2-CH2-CH2Br | B. | CH2═CH-CH2-CH2-CH2Cl | ||
| C. | CH3Cl | D. | CH2═CH-CH2-C(CH3)2CH2Cl |
15.一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右,然后恢复至室温(20℃).这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍.下列判断正确的是( )
| A. | m=2,n=4 | B. | m=0.5,n=4 | C. | m=2,n=0.25 | D. | m=0.5,n=0.25 |
16.医学上在对抗癌物质的研究中发现 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )
 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )| A. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| B. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 | |
| C. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| D. | 两者为同一物质,都是以Pt原子为中心的平面结构 |
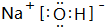 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.