题目内容
7.下列对化学知识概括合理的是( )| A. | 金属氧化物都是强电解质 | |
| B. | 一种金属元素只能有一种氧化物 | |
| C. | 在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化 | |
| D. | 能与金属铝反应产生氢气的溶液一定是酸溶液 |
分析 A、金属氧化物是电解质,不一定都是强电解质;
B、一种金属元素的不种化合价不一定只对应一种氧化物;
C、化学变化的实质就是旧化学键的断裂与新化学键的生成,此间伴随能量的变化;
D、铝和强酸强碱溶液都反应.
解答 解:A、金属氧化物是电解质,但不一定是强电解质,如HgO不是强电解质,故A错误;
B、一种金属元素的不种化合价不一定只对应一种氧化物如:FeO、Fe2O3,Fe3O4,故B错误;
C、化学变化的实质就是旧化学键的断裂与新化学键的生成,化学反应过程中一定伴随能量的变化,故C正确;
D、铝和强酸、强碱溶液都可以发生反应生成氢气,能与金属铝反应产生氢气的溶液不一定是酸溶液,故D错误;
故选C.
点评 本题主要考查的是电解质的概念,化学反应实质理解,铝的性质分析判断,强电解质与弱电解质的区别等,属于基础题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.一定量铜在某浓硝酸溶液中完全溶解,已知参加反应的30g HNO3中被还原的HNO3质量为13g,则生成的NO和NO2的体积比为(同温同压下测定)( )
| A. | 1:1 | B. | 1:2 | C. | 2:11 | D. | 4:1 |
15.下列热化学方程式中△H代表燃烧热的是( )
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
2.下列各组元素中,按最高正化合价递减的顺序排列的是( )
| A. | C、N、Cl | B. | F、O、H | C. | S、P、Si | D. | Na、Mg、Al |
12.下列各项不属于官能团的是( )
| A. | NO3- | B. | -Cl | C. | -CHO | D. | -NO2 |
19.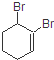 的系统命名的名称是( )
的系统命名的名称是( )
 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
17.如图是立方烷的球棍模型,下列有关说法正确的是( )
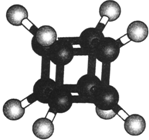

| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它不易燃烧 | |
| D. | 它与苯乙烯(C6H5-CH═CH2)不是同分异构体 |
 碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题:
碳、氮元素及其化合物在生产、生活和科学研究等方面有着重要的作用研究它们的结构与性质意义重大.请回答下列有关问题: .
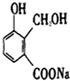
. 有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )
有一化合物(X)结构简式如图,它与分别与金属钠、氢氧化钠和碳酸氢钠反应时,不可能生成的产物是( )