18.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
17.下列有关物质用途的说法不正确的是( )
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
15.分析下表中各项的排布规律.有关第23、24项说法中不正确的是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 23 | 24 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | M | N |
| A. | M为C9H20O | B. | N为C9H18O2 | ||
| C. | M、N均可发生加成反应 | D. | M、N均可能发生取代反应 |
14.X、Y、Z、W、R属于短周期主族元素,X在短周期主族元素中原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 原子半径:X>R>Z>Y | |
| B. | 最高价氧化物对应水化物的酸性:R>Z>W | |
| C. | 对应单质的沸点:X>Z>Y | |
| D. | RY2、WY2通入BaCl2溶液中均无白色沉淀生成 |
13.同温同压下,由C、H、O组成的有机物X的蒸汽相对氢气的密度为51,X中氧元素的质量分数为31.4%,则能在酸性条件下发生水解反应的X的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
10.A、B、C、D、E是由五种短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中B是由极性键构成的4原子分子,A和C反应可生成B和D.
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
9.BLAl2(SO4)3溶液中含有agAl3+,则SO42-的物质的量浓度为( )
0 166874 166882 166888 166892 166898 166900 166904 166910 166912 166918 166924 166928 166930 166934 166940 166942 166948 166952 166954 166958 166960 166964 166966 166968 166969 166970 166972 166973 166974 166976 166978 166982 166984 166988 166990 166994 167000 167002 167008 167012 167014 167018 167024 167030 167032 167038 167042 167044 167050 167054 167060 167068 203614
| A. | $\frac{3a}{2B}$mol/L | B. | $\frac{a}{27B}$mol/L | C. | $\frac{a}{18B}$mol/L | D. | $\frac{2a}{81B}$mol/L |
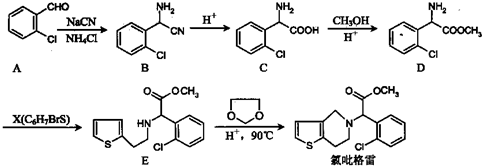
 .
. .
.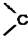 =O$→_{H+}^{ROH}$
=O$→_{H+}^{ROH}$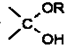 $→_{H+}^{ROH}$
$→_{H+}^{ROH}$ 写出由乙烯、甲醇为有机原料制备化合物
写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2Br•CH2Br.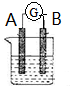 如图所示为原电池装置示意图.
如图所示为原电池装置示意图.