题目内容
18.下列有关能量的叙述不正确的是( )| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
分析 A、活化能的大小对化学反应前后的能量变化不产生影响;
B、根据化学反应中发生能量变化的主要原因是化学键的断裂和形成;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
D、CO燃烧放热,则反应2CO2 (g)=2CO(g)+O2(g)吸热.
解答 解:A、活化能的大小对化学反应前后的能量变化不产生影响,故A正确;
B、因化学反应中发生能量变化的主要原因是化学键的断裂和形成,故B正确;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3KJ/mol,故C错误;
D、CO(g)的燃烧热是283.0kJ/mol,则表示燃烧热的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ/mol,当方程式反写△H符号相反,计量数变化几倍△H也要变化几倍,所以2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,故D正确.
故选C.
点评 本题考查能量的转换形式,燃烧热的概念,注意准确把握燃烧热的概念,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 小苏打溶液呈碱性的原因:HCO3-+H2O?H3O++CO32- | |
| B. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 少量A1Cl3溶液滴入过量氨水中:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
13.同温同压下,由C、H、O组成的有机物X的蒸汽相对氢气的密度为51,X中氧元素的质量分数为31.4%,则能在酸性条件下发生水解反应的X的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
10.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
9.从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是( )
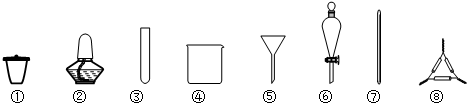

| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
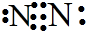 和结构式N≡N.
和结构式N≡N.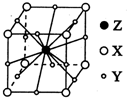 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.