题目内容
15.分析下表中各项的排布规律.有关第23、24项说法中不正确的是( )| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 23 | 24 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | M | N |
| A. | M为C9H20O | B. | N为C9H18O2 | ||
| C. | M、N均可发生加成反应 | D. | M、N均可能发生取代反应 |
分析 根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,所以按此规律排布的第23项是第8组中的第2个,分子式为C9H20O,第24项为第8组的第三个,其分子式为C9H18O2,据此再结合有机物结构与性质进行判断.
解答 解:根据表中排布可知,每3个为一组,第一组碳原子为数为2,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,第二组碳原子为数为3,分别符合通式CnH2n+2、CnH2n+2O、CnH2nO2,所以按此规律排布的第23项是第8组中的第2个,分子式为C9H20O,第24项为第8组的第三个,其分子式为C9H18O2,
A.根据分析可知,M的分子式为C9H20O,故A正确;
B.根据分析可知,N的分子式为C9H18O2,故B正确;
C.M为C9H20O,根据氢离子数目可知其分子已经达到饱和结构,不存在不饱和键,故不能发生加成反应,故C错误;
D.M为C9H20O,可能为醇类物质,N为C9H18O2,可能为羧酸,醇和羧酸都能够发生酯化反应,酯化反应属于取代反应,故D正确;
故选C.
点评 本题主要考查探究化学规律,题目难度中等,根据表中排布规律推导出MN的分子式为解题的关键,试题侧重考查学生的分析、归纳能力及灵活应用基础知识的能力,注意掌握常见有机物结构与性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.A、B、C、D、E是由五种短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
其中B是由极性键构成的4原子分子,A和C反应可生成B和D.
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
20.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组所有的元素组合,既可形成离子化合物,又可形成共价化合物的是( )
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
7.能正确表示下列反应的离子方程式是( )
| A. | 将足量Cl2通入溴化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | AlCl3溶液中通入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 碳酸氢钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O |

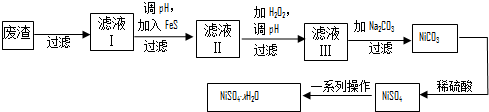
 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.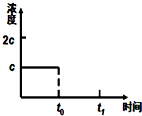 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题: