7.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.回答下列问题:
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
分析上表中的相关数据,请回答:NH3的沸点比PH3的高的原因是NH3存在分子间氢键;CH4的分解温度比SiH4的高的原因是C-H键的键能大于Si-H键的键能.
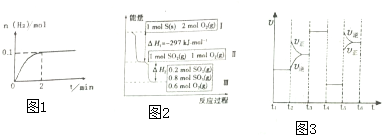
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH, (PAN)等二次污染物.
(PAN)等二次污染物.
①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
6.下列实验操作、现象和结论均正确的是( )


| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②将铜丝向下移动使其与浓硝酸接触 | 产生红棕色气体,用排水法收集气体 | 可以用该装置制备NO2 |
| C | ③光照 | 试管颜色变浅,出现油状滴液,少量白雾 | 甲烷与氯水发生取代反应 |
| D | 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
4.已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11,下列判断正确的是( )
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
3.已知:常温下,0.01mol•L-1MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸与强酸稀溶液反应的中和热为△H=-57.3kJ•mol-1,则MOH的水溶液中电离的△H为( )
| A. | -69.4kJ•mol-1 | B. | -45.2kJ•mol-1 | C. | +69.4kJ•mol-1 | D. | +45.2kJ•mol-1 |
2.如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是( )
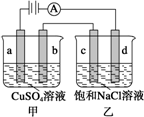

| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
1.已知:NO2(g)+SO2(g)$\frac{\underline{\;一定条件\;}}{\;}$SO3(g)+NO(g),现将体积之比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3与NO的体积比保持不变 | D. | 每消耗1molSO2,同时生成1molNO |
20.解释下列事实的离子方程式不正确的是( )
| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
19.六氯丙烷(C3H2Cl6的同分异构体有( )
0 166849 166857 166863 166867 166873 166875 166879 166885 166887 166893 166899 166903 166905 166909 166915 166917 166923 166927 166929 166933 166935 166939 166941 166943 166944 166945 166947 166948 166949 166951 166953 166957 166959 166963 166965 166969 166975 166977 166983 166987 166989 166993 166999 167005 167007 167013 167017 167019 167025 167029 167035 167043 203614
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$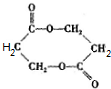 +2H2O;
+2H2O;