题目内容
5.以化学反应原理为依据,以实验室研究为基础,可以实验许多化工生产Ⅰ.分解水制氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
①SO2+2H2O+I2=H2SO4+2HI ②2HI?H2+I2 ③2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是bc
a.循环过程中产生1molO2的同时产生1molH2
b.反应①中SO2还原性比HI强
c.循环过程中需补充H2O
d.反应③易在常温下进行
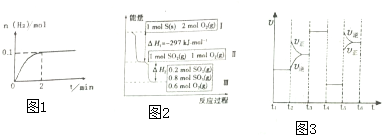
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应②,H2物质的量随时间的变化如图1所示,0-2min内的平均反应速率v(HI)=0.05mol/(L.min);HI的转化率=20%
(3)恒温恒容条件下,硫发生转化的反应过程和能量关系如图2所示.请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1
②恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|大(填“大”、“小”或“相等”)
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,工业上可由石英与焦炭的高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H<0
(1)该反应平衡常数的表达式为K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$,升高温度,其平衡常数减小(填“增大”、“减少”或“不变”)
(2)该化学反应速率与反应时间的关系如图3所示,t2时引起v正突变的原因是增大了氮气的浓度,t3引起变化的因素为加入催化剂,t5时引起v正小变化、v逆大变化的原因是升高温度或增大压强(或缩小容器体积)
分析 I.(1)a.由③可知产生lmolO2的同时产生2molSO2,由①可知2molSO2生成4molHI,由②可知4molHI分解生成2mol H2;
b.还原剂还原性强于还原产物的还原性;
c.反应①中1molSO2消耗2molH2O生成1molH2SO4,反应③中1molH2SO4分解生成1molSO2与1molH2O;
d.硫酸常温下,不易分解;
(2)由图可知,2min内H2物质的量的变化量,根据ν=$\frac{\frac{△n}{V}}{△t}$计算v(H2),再利用化学反应速率之比等于化学计量数之比计算v(HI);
计算参加反应HI物质的量,HI的转化率=$\frac{参加反应的HI物质的量}{HI起始物质的量}$×100%;
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由图可知硫的燃烧热为297kj/mol,表明物质的聚集状态书写热化学方程式;
②恒温恒容时,1molSO2和2molO2充分反应,到达的平衡状态,相当于在Ⅱ平衡的基础上再加入1molO2,平衡向正反应方向移动,平衡时放出的热量较Ⅱ到达平衡时放出的热量多;
Ⅱ.(1)平衡常数是,一定温度下,可能反应得到平衡时,生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值,注意固体和纯液不代入表达式;
正反应为放热反应,升高温度,平衡向逆反应分析移动,平衡常数减小;
(2)t2时瞬间,v正增大、v逆不变,应是增大反应物浓度;
t3时刻,平衡未移动,正逆反应速率同等程度增大,而两边气体的化学计量数不等,故不是增大压强,应是加入催化剂;
t5时引起v逆、v正都变大,但v逆>v正平衡逆向移动,正反应为气体体积增大的放热反应,可能是升高温度或增大压强.
解答 解:I.(1)a.由③可知产生lmolO2的同时产生2molSO2,由①可知2molSO2生成4molHI,由②可知4molHI分解生成2mol H2,故循环过程中产生1molO2的同时产生2molH2,故a错误;
b.反应中二氧化硫表现还原性,HI为还原产物,还原剂还原性强于还原产物的还原性,故b正确;
c.反应①中1molSO2消耗2molH2O生成1molH2SO4,反应③中1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.硫酸常温下温度,不易分解,故d错误,
故答案为:bc;
(2)由图可知,2min内氢气的物质的量增加了0.1mol,体积为2L,故v(H2)=$\frac{\frac{0.1mol}{2L}}{2min}$=0.025mol/L,则v(HI)=2v(H2)=0.025mol/(L.min)×2=0.05mol/(L.min);
参加反应的HI为0.1mol×2=0.2mol,故HI的转化率为$\frac{0.2mol}{1mol}$×100%=20%,
故答案为:0.05mol/(L.min);20%;
(3)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以硫的燃烧热的热化学方程式为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1,
故答案为:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1;
②恒温恒容时,1molSO2和2molO2充分反应,到达的平衡状态,相当于在Ⅱ平衡的基础上再加入1molO2,平衡向正反应方向移动,平衡时放出的热量较Ⅱ到达平衡时放出的热量多,即恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|大,
故答案为:大;
Ⅱ.(1)可逆反应:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H<0,其平衡常数表达式K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$,正反应为放热反应,升高温度,平衡向逆反应分析移动,平衡常数减小,
故答案为:$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;减小;
(2)t2时瞬间,v正增大、v逆不变,应是增大反应物浓度,即增大氮气的浓度;
t3时刻,平衡未移动,正逆反应速率同等程度增大,而两边气体的化学计量数不等,故不是增大压强,应是加入催化剂;
t5时引起v逆、v正都变大,但v逆>v正平衡逆向移动,正反应为气体体积增大的放热反应,可能是升高温度或增大压强(或缩小容器体积),
故答案为:增大了氮气的浓度;加入催化剂;升高温度或增大压强(或缩小容器体积).
点评 本题属于拼合型题目,涉及对工艺流程的理解、热化学方程式书写、平衡常数、平衡移动影响因素及平衡图象等,图3注意分析改变条件瞬间正逆反应速率变化、判断平衡移动,结合外界条件对反应速率影响及反应特征进行分析,难度中等.

| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
| A. | CO2的电子式: | |
| B. | Cl原子的结构示意图: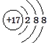 | |
| C. | 质子数为53,中子数为78的碘原子的核素符号:${\;}_{53}^{131}$I | |
| D. | 2,3-二甲基-2-丁烯的结构简式: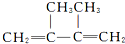 |
| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移4mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
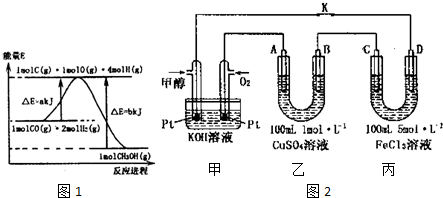
(1)合成甲醇的反应过程中物质能量变化如图1所示.写出合成甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol.
(2)实验室在lL密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L-l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
②500℃时平衡常数K的数值为25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是cd(选填编号).
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
(3)如图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①甲中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中A极析出的气体在标准状况下的体积为2.24l;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要300mL5.0mol•L-lNaOH 溶液.

 某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.