题目内容
2.如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是( )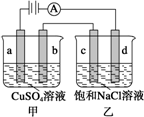
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
分析 由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序写出电极反应分别为甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,以此来解答.
解答 解:A.乙中发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,通入适量HCl气体,溶液组成可以恢复,而不是盐酸,故A错误;
B.乙中d电极反应为:4H++4e-=2H2↑,促进水的电离,导致c(OH-)>c(H+),呈碱性,则电解时向乙中滴入酚酞试剂,d电极附近变红,故B错误;
C.当b极有64g Cu析出时,根据Cu2++2e-=Cu可知转移2mol电子,c电极发生2Cl--2e-=Cl2↑,则生成氯气1mol,质量为71g,故C错误;
D.a为电解池阳极,发生4OH--4e-=O2↑+2H2O,故D正确.
故选D.
点评 本题考查了原电池和电解池的工作原理应用,电极判断,电极反应书写,电子转移的计算应用,明确两个烧杯中的电极反应是解答本题的关键,并注意装置特点及电子守恒来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.在一定温度下,将气体X和气体Y各0.16mol充入10.1,恒容器闭容器中,发生反应X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
7.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.回答下列问题:
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
分析上表中的相关数据,请回答:NH3的沸点比PH3的高的原因是NH3存在分子间氢键;CH4的分解温度比SiH4的高的原因是C-H键的键能大于Si-H键的键能.
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图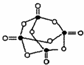 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH, (PAN)等二次污染物.
(PAN)等二次污染物.
①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则$\frac{m}{n}$=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=$\root{3}{\frac{4M}{ρ•{N}_{A}}}$×107nm.
14.海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等砝码,如图1是含碘CCl4溶液得到碘的实验过程.
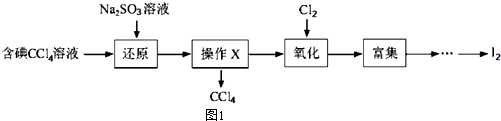
完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
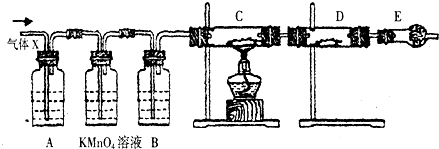
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液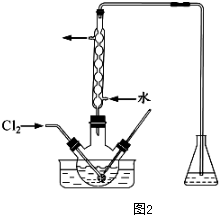
(4)浓海水提取镁的工艺流程如图3所示
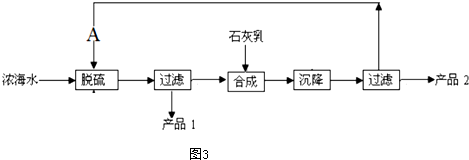
浓海水的主要成分如下
该工艺过程中,脱碱阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓产品2的化学式为Mg(OH)2
1L浓海水最多可得到产品2的质量为69.6g.

完成下列填空
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+该操作将I2还原为I的目的是将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液
(2)操作X的名称为分液,所用的主要仪器是分液漏斗
(3)氧化时,在三颈瓶中将含“I”的水溶液用盐酸调至pH约为2,华安满通入Cl2,在40℃左右反应(实验装置如图2所示),实验控制在较低温度下进行原因是防止碘升华或者被氧化、增大氯气溶解度锥形瓶中的溶液为NaOH溶液

(4)浓海水提取镁的工艺流程如图3所示

浓海水的主要成分如下
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
1L浓海水最多可得到产品2的质量为69.6g.
12.已知平衡:
①C2H4(g)?C2H2(g)+H2(g),
②2CH4(g)?C2H4(g)+2H2(g).当升高温度时,①和②式皆向右移动.
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
下列有关(1)、(2)和(3)中的△H1、△H2、△H3大小顺序排列正确的是( )
①C2H4(g)?C2H2(g)+H2(g),
②2CH4(g)?C2H4(g)+2H2(g).当升高温度时,①和②式皆向右移动.
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
下列有关(1)、(2)和(3)中的△H1、△H2、△H3大小顺序排列正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2>△H3>2△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△H1 |
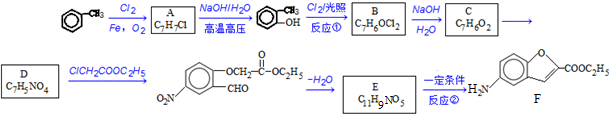
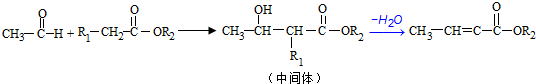
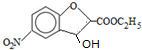 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;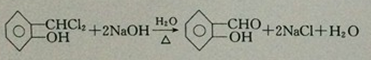 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为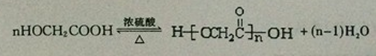 ;
;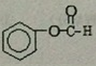 .
.