题目内容
7.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.回答下列问题:(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN一之间化学键类型为配位键键,与CN一互为等电
子体的化合物分子式为CO.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(4)白磷(P4)是正四面体构型的分子,与氧气作用可形成P4O10,P4O10的分子结构如图
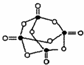 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH若每个P4 O10分子与四个水分子发生反应,写出该反应的化学方程式P4O10+4H2O=2H4P2O7
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NO2,O3,CH2=CHCHO,HCOOH,
 (PAN)等二次污染物.
(PAN)等二次污染物.①N20结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为sp2、sp,1mol PAN中含σ键数目为10NA.
②测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则mn=3(填数字).已知Kr晶体的密度为ρ g/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a=\root{3}{\frac{4M}{ρ•{N}_{A}}}×107nm.
分析 (1)As的原子序数为33,根据能量最低原理书写电子排布式;
(2)当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;根据等电子体原理可写出与CN一互为等电子体的化合物分子式;
(3)利用相对分子质量分析分子间作用力,并注意氨气分子中有氢键;非金属性越强,分子内共价键的键能越大,气态氢化物越稳定,则越难分解;
(4)依据原子守恒写出化学方程式即可;
(5)①根据氮原子的价层电子对数判断杂化方式,一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;
②以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×18+6×12=4,然后求出比值;根据V=mρ求得晶胞的体积,进而可求得晶胞边长;
解答 解:(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,与CN一互为等电子体的化合物分子式为 CO,
故答案为:配位键; CO;
(3)因结构相似时,相对分子质量越大,分子间作用力越大,但氨气分子间还存在氢键,所以NH3的沸点高于PH3,因 C-H键的键能大于Si-H键的键能,所以CH4的分解温度比SiH4高,
故答案为:NH3存在分子间氢键;C-H键的键能大于Si-H键的键能;
(4)据原子守恒,每个P4O10分子与四个水分子发生化合反应的方程式为:P4O10+4H2O=2H4P2O7,
故答案为:P4O10+4H2O=2H4P2O7;
(5)①在N=N=O中,边上的氮原子的价层电子对数为5+12=3,所以是sp2杂化,中间氮原子的价层电子对数为5−12=2,所以是sp杂化,根据 的结构可知,每个分子中含有10个σ键,所以1mol PAN中含σ键数目为10NA,
的结构可知,每个分子中含有10个σ键,所以1mol PAN中含σ键数目为10NA,
故答案为:sp2、sp;10NA;
②以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×18+6×12=4,所以m:n=12:4=3;根据V=mρ可知晶胞的体积为4MNAρcm3=4Mρ•NAcm3,所以晶胞边长a=\root{3}{\frac{4M}{ρ•{N}_{A}}}cm=\root{3}{\frac{4M}{ρ•{N}_{A}}}×107nm,
故答案为:3;\root{3}{\frac{4M}{ρ•{N}_{A}}}×107.
点评 本题考查物质的结构与性质,注重对电子排布式、沸点比较、稳定性的比较及应用、化学键、原子杂化方式、晶胞的计算等知识,难度中等,注重基础知识的考查.

 阅读快车系列答案
阅读快车系列答案| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
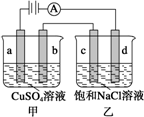
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | c(H+)c(OH−)=10-12的溶液K+、Na+、AlO2-、CO32- |
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
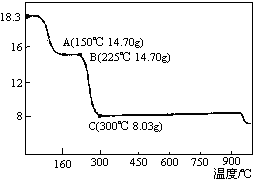 草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.