题目内容
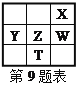
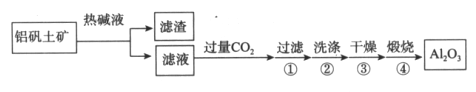
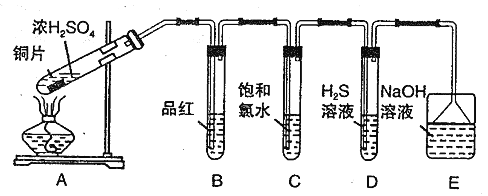
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
【答案】 放热 KOH(K2CO3) 不能 浓H2SO4溶于水放出大量的热,平衡也会逆向移动,所以溶液橙色加深,不能说明是由氢离子浓度的增大,平衡逆向移动(或能冷却至室温,溶液橙色加深,说明氢离子浓度的增大,平衡逆向移动) 在酸性条件下,K2Cr2O7的氧化性更强(或K2Cr2O7氧化性比K2CrO4强) 重铬酸钾溶液中存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+,SO
+2H+,SO![]() 与H+结合,降低c(H+),平衡正向移动,溶液变为黄色 Cr2O
与H+结合,降低c(H+),平衡正向移动,溶液变为黄色 Cr2O![]() +3SO
+3SO![]() +8H+=2Cr3++3SO
+8H+=2Cr3++3SO![]() +4H2O
+4H2O
【解析】(1)i加热温度升高溶液橙色加深可证明反应![]() +H2O
+H2O![]() 2
2![]() +2H+逆向移动,逆反应为吸热反应,则正反应是放热反应;(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a可以选择能只与氢离子反应的物质,如KOH、K2CO3等;(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是浓H2SO4溶于水放出大量的热,平衡也会逆向移动,所以溶液橙色加深,不能说明是由氢离子浓度的增大,平衡逆向移动(或能冷却至室温,溶液橙色加深,说明氢离子浓度的增大,平衡逆向移动);(4)根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强(或K2Cr2O7氧化性比K2CrO4强);(5)①重铬酸钾溶液中存在平衡:Cr2
+2H+逆向移动,逆反应为吸热反应,则正反应是放热反应;(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a可以选择能只与氢离子反应的物质,如KOH、K2CO3等;(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是浓H2SO4溶于水放出大量的热,平衡也会逆向移动,所以溶液橙色加深,不能说明是由氢离子浓度的增大,平衡逆向移动(或能冷却至室温,溶液橙色加深,说明氢离子浓度的增大,平衡逆向移动);(4)根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强(或K2Cr2O7氧化性比K2CrO4强);(5)①重铬酸钾溶液中存在平衡:Cr2![]() +H2O
+H2O![]() 2Cr
2Cr![]() +2H+,
+2H+,![]() 与H+结合,降低c(H+),平衡正向移动,溶液变为黄色;②重铬酸钾溶液被亚硫酸钠还原产生Cr3+,溶液变绿色,反应的离子方程式是Cr2
与H+结合,降低c(H+),平衡正向移动,溶液变为黄色;②重铬酸钾溶液被亚硫酸钠还原产生Cr3+,溶液变绿色,反应的离子方程式是Cr2![]() +3
+3![]() +8H+=2Cr3++3
+8H+=2Cr3++3![]() +4H2O。
+4H2O。