题目内容
1898年,IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)建议用1~18列代替原周期表中主族、副族序号,请问原第IVA族应该在第几列?
| A.第4列 | B.第14列 |
| C.第5列 | D.第15列 |
B
解析试题分析:根据元素周期表的结构可知,元素周期表共分为18列。自左向右依次是第IA、ⅡA、ⅢB~ⅦB、Ⅷ(包括8、9、10三列)、IB、ⅡB、ⅢA~ⅦA、0族,所以原第IVA族应该在第14列,答案选B。
考点:考查元素周期表的结构
点评:该题是基础性试题的考查,试题紧扣教材,基础性强,旨在巩固学生的教材,提高学生的应试能力,难度不大。关键是熟练记住元素周期表的结构,然后灵活运用即可。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构, |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
下列排列顺序不正确的是
| A.热稳定性:CH4> SiH4 >HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
下列分子中所有原子都满足最外层为8电子结构的是( )
| A.CS2 | B.PCl5 | C.HClO | D.BeCl2 |
下列说法正确的是( )
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| D.Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |
(8分每空1分)
(1)下列3种不同粒子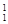 H、
H、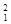 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,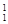 H、
H、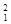 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.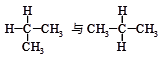 | D. |
(3)K2O: ;(4)CO2: 。
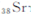 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与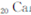
 同属于第ⅡA族?
同属于第ⅡA族?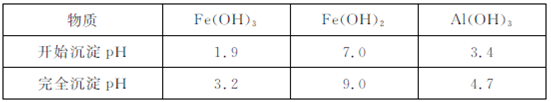
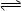 C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;