题目内容
(10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是_____________;写出它的氧化物与氢氧化钠反应的离子方程式____________________________________________。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程_________________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为______________________ ,该化合物是由___________ (填“极性”“非极性”)键形成的。
(1)Ar (2)HClO4 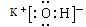 (3)Al Al2O3+2OH-==2AlO2-+H2O
(3)Al Al2O3+2OH-==2AlO2-+H2O
(4)Na2S的形成过程略 离子 (5)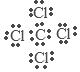 极性
极性
解析试题分析:(1) 根据元素在周期表中的位置及元素性质的关系可知:在这些元素中,化学性质最不活泼的是⑧元素Ar;(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物KOH的电子式是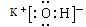 ; (3) 最高价氧化物是两性氧化物的元素是Al;它的氧化物与氢氧化钠反应的离子方程式是Al2O3+2OH-==2AlO2-+H2O;(5)元素①C与⑦元素Cl形成的的化合物CCl4的电子式为
; (3) 最高价氧化物是两性氧化物的元素是Al;它的氧化物与氢氧化钠反应的离子方程式是Al2O3+2OH-==2AlO2-+H2O;(5)元素①C与⑦元素Cl形成的的化合物CCl4的电子式为 ;该化合物是由不同种非金属元素形成的极性键形成的。
;该化合物是由不同种非金属元素形成的极性键形成的。
考点:考查元素周期表、元素周期律的应用的知识。

练习册系列答案
相关题目
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
(8分每空1分)
(1)下列3种不同粒子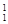 H、
H、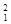 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,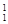 H、
H、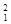 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.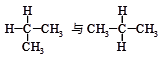 | D. |
(3)K2O: ;(4)CO2: 。
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| | | | |||||
| | | | a | | | | |
| | b | | c | | | d | |
(1)元素b的基态原子电子排布式为 。
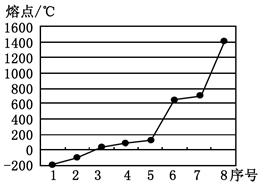
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
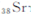 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与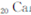
 同属于第ⅡA族?
同属于第ⅡA族?
 C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;