题目内容
(8分)元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式__________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物中最不稳定的是________(填化学式)。
(3) A、B、C的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的结构式为________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
(1) 1s22s22p63s23p2;3s23p5 (2)SiH4 (3)HClO4
1s22s22p63s23p2;3s23p5 (2)SiH4 (3)HClO4
(4)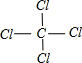 ;sp3;非极性
;sp3;非极性
解析试题分析:元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个电子,则A的外围电子排布为2s22p2,故A为碳元素;B的3p轨道上有空轨道,则B的A的外围电子排布为3s23p1或3s23p2,A、B同主族,故B为硅元素;B、C同周期,C是本周期中电负性最大的,故C为氯元素,则
(1)A为碳元素,碳原子的 ;B为硅元素,Si原子的核外电子排布式为1s22s22p63s23p2;C为氯元素C原子的核外电子排布式为1s22s22p63s23p5,价电子排布式为3s23p5;
;B为硅元素,Si原子的核外电子排布式为1s22s22p63s23p2;C为氯元素C原子的核外电子排布式为1s22s22p63s23p5,价电子排布式为3s23p5;
(2)C为氯元素,最低负价为-1价,气态氢化物的化学式是 HCl;非金属性越强,氢化物越稳定,非金属性Cl>C>Si,所以氢化物稳定性HCl>CH4>SiH4,气态氢化物最不稳定的化学式是SiH4;
(3)非金属性越强,最高价氧化物的水化物酸性越强,非金属性Cl>C>Si,所以酸性HClO4>H2CO3>H2SiO3,酸性最强的是 HClO4;
(4)AC4的化学式CCl4,分子中碳原子与氯原子之间形成1对共用电子对,结构式为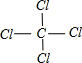 ,中心原子C原子的杂化轨道数为4,碳原子采取sp3杂化,分子为正四面体对称结构,是非极性分子。
,中心原子C原子的杂化轨道数为4,碳原子采取sp3杂化,分子为正四面体对称结构,是非极性分子。
考点:考查结构与物质关系、核外电子排布规律、常用化学用语、分子结构等

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案下列排列顺序不正确的是
| A.热稳定性:CH4> SiH4 >HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
(8分每空1分)
(1)下列3种不同粒子 H、
H、 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,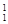 H、
H、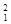 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.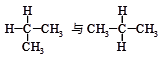 | D. |
(3)K2O: ;(4)CO2: 。
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| | | | |||||
| | | | a | | | | |
| | b | | c | | | d | |
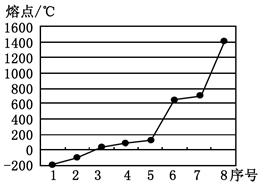
(1)元素b的基态原子电子排布式为 。
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
下表是元素周期表的一部分,针对所给的元素,完成下列各小题。
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | C | N | O | |
| 3 | Na | | Al | Si | | S | Cl |
21. 第3周期中金属性最强的元素是 (填元素名称)。
22. C、N和O原子半径由小到大的顺序的是 。
23. 第3周期中气态氢化物最稳定的是 (填化学式)。
24. Si是带来人类文明的重要元素之一,其氧化物化学式是 。
25. 铝是大自然赐予人类的宝物。它的一个用途是发生铝热反应,冶炼某些难熔金属,写出
该反应的一个化学方程式 。
26. S元素形成的氢化物与其氧化物SO2相遇后的现象是 。
 C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;