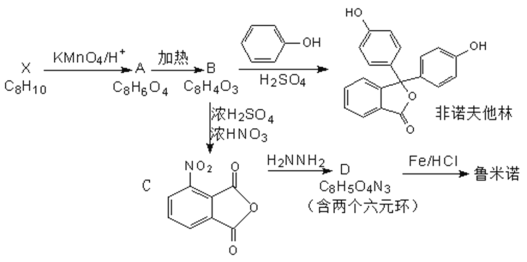
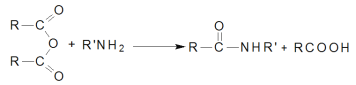
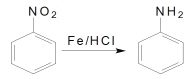
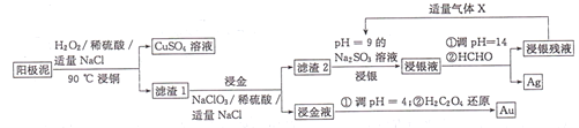
题目内容
【题目】常温下,用0.lmolL-1的盐酸滴定10.0mL0.lmolL-1Na2A溶液,所得滴定曲线如图所示.下列说法正确的是
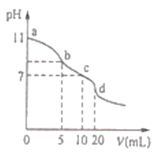
A.常温下,A2-的水解常数Khl(A2-)的数量级为10-6
B.b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-)
C.c点溶液中:c(HA-)+c(A2-)+c(H2A)=0.lmolL-1
D.d点溶液中:c(A2-)+c(HA-)=c((H+)<c(OH-)
【答案】B
【解析】
A.0.lmolL-1Na2A溶液,pH=11,则Na2A为强碱弱酸盐,A2-+H2O![]() HA-+OH-,A2-水解程度比较小,则溶液中c(A2-) ≈ 0.lmolL-1,c(HA-) ≈ c(OH-)=
HA-+OH-,A2-水解程度比较小,则溶液中c(A2-) ≈ 0.lmolL-1,c(HA-) ≈ c(OH-)=![]() =0.001molL-1,常温下,A2-的水解常数Kh1(A2-) =
=0.001molL-1,常温下,A2-的水解常数Kh1(A2-) = ![]() =
= ![]() =10-5,A错误;
=10-5,A错误;
B.b点溶液中溶质为等物质的量浓度的NaHA、Na2A、NaCl,由电荷守恒可知,c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(HA-)+2c(A2-),由物料守恒可知,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)],由电荷守恒、物料守恒式子结合可知,b点溶液中:c(HA-)+2c(H2A)+c(H+)=c(Cl-)+c(OH-),B正确;
C.c点溶液中溶质为等物质的量浓度的NaHA、NaCl,溶液的体积增大一倍,所以c(HA-)+c(A2-)+c(H2A)=0.05molL-1,C错误;
D.d点溶液中溶质为H2A、NaCl,溶液呈酸性,c((H+)c(OH-),D错误;
答案选B。

【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
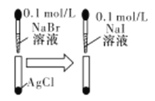
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D