题目内容
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
【答案】D
【解析】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释至1000mL,HA溶液pH=5,说明HA为强酸,HB为弱酸;则A.pH均为2的两种一元酸HA和HB各1mL,分别加水稀释1000倍,HA溶液pH=5,HB溶液pH小于5,HA的酸性比HB的酸性强,A错误;B.a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度大小,则a点溶液的导电性比c点溶液的导电性强,B错误;C.溶液稀释氢离子浓度减小,而水的离子积Kw=c(H+)·c(OH-)不变,故c(OH-)增大,C错误;D.HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,c(A-)浓度不变,HB电离程度增大,c(B-)浓度增大,c(A-)/c(B-)比值减小,D正确;答案选D。

【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
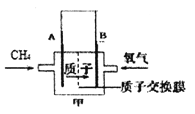
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
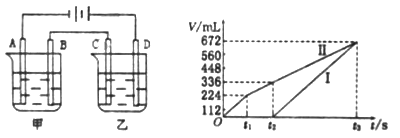
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。



