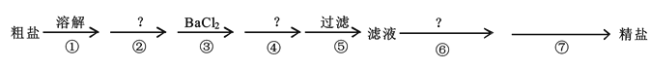
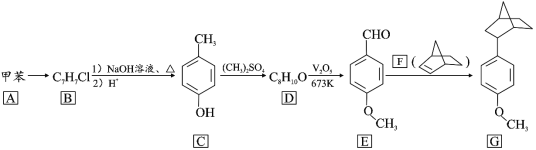
题目内容
【题目】最近一期《物理评论快报》报道了科学家成功制备了包含钙(Ca)、钾(K)、铁(Fe)和砷(As)以及少量镍(Ni)的新型化合物材料[CaK(Fe1-x一Nix)4As4).回答下列问题:
(1)基态镍原子的价层电子排布式为________,基态砷原子最高能级的电子云有________个伸展方向.
(2)亚铁氰化钾{K4[Fe(CN)6]}是食盐中广泛使用的抗结剂,化学式中涉及的所有元素的笫一电离能由小到大的顺序为________,[Fe(CN)6]4-中,铁提供的空轨道数目为________,气态化合物X与CN一互为等电子体,则X的化学式为________.
(3)AsCl3分子中砷的杂化类型为________;其空间构型为________。
(4)已知:CaO、K2S的熔点分别为2572℃、840℃,二者熔点差异的主要原因是________。
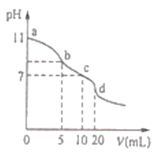
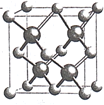
(5)镍和硫形成的某晶体.其晶胞如图所示.巳知该晶体密度为dgcm-3,NA为阿伏加德罗常数的值。则Ni、S原子最短核间距(D)为________________cm。
【答案】3d84s2 3 K<Fe<C<N 6 CO(或其他合理答案) sp3 三角锥形 CaO、K2S都是离子晶体.Ca2+所带电荷数大于K+且Ca2+的半径小于K+.O2-的半径小于S2-,故CaO的晶格能大于K2S.所以熔点CaO>K2S 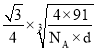
【解析】
(1)依据镍元素的原子序数为28,确定基态镍原子的核外电子排布式;依据砷元素的原子序数为33,其价电子排布式,确定基态砷原子最高能级,然后确定在确定最高能级的伸展方向;
(2)根据元素在周期表的位置特征,判断元素的第一电离能;
(3)根据价层电子对数确定中心原子的杂化类型,结合价层电子对数和孤电子对数确定分子的空间构型;
(4)离子晶体晶格能越大晶体的熔点越高,找出影响晶格能大小的因素;
(5)利用均摊法计算出1个晶胞中含有Ni、S的原子个数,结合密度和阿伏加德罗常数,计算出晶胞的棱长。
(1)镍元素的原子序数为28,基态镍原子的价层电子排布式为3d84s2;砷元素的原子序数为33,属于第四周期第ⅤA族,基态砷原子的核外电子排布式为[Ar]3d104s24p3,最高能级为4p,其电子云有3个伸展方向;
(2)一般金属性越强第一电离能越小,同周期主族元素随原子序数的增大第一电离能呈增大趋势,第ⅡA族、第ⅤA族元素的第一电离能大于同周期相邻元素的第一电离能,故第一电离能由小到大的顺序为 K<Fe<C<N;Fe2+与CN-形成6个配位键,[Fe(CN)6]4-中铁提供的空轨道数目为6;原子个数相同,价电子数相等的几种不同的分子互为等电子体,故与CN-互为等电子体的气体分子为N2或CO;
(3)1个AsCl3分子中含有3个![]() 键,中心原子As含有一对孤电子对,价层电子对数为4,故AsCl3分子中砷的杂化类型为sp3;其空间构型为三角锥形。
键,中心原子As含有一对孤电子对,价层电子对数为4,故AsCl3分子中砷的杂化类型为sp3;其空间构型为三角锥形。
(4)离子晶体熔沸点的高低与晶格能的大小有关,离子晶体的晶格能越大,离子晶体的熔沸点越高。离子所带电荷数越多、离子半径越小,晶格能越大。Ca2+所带电荷数比K+所带电荷数多,且Ca2+半径比K+半径小,所以晶格能CaOK2S,熔点CaOK2S;
(5)晶胞顶点原子与四面体中心原子距离最近,二者连线处于体对角线上,可知二者最短距离为体对角线长度的![]() ,晶胞的体对角线的长度是晶胞棱长的
,晶胞的体对角线的长度是晶胞棱长的![]() 倍,由NiS的晶胞图可知,一种原子有8个在顶点,6个在面心,该原子的个数为
倍,由NiS的晶胞图可知,一种原子有8个在顶点,6个在面心,该原子的个数为![]() =4,另一种原子有4个在体心,故一个NiS的晶胞中含有4个Ni原子和4个S原子,令晶胞的棱长为acm,则a3×d×NA=4×(59+32)=4×91,a=
=4,另一种原子有4个在体心,故一个NiS的晶胞中含有4个Ni原子和4个S原子,令晶胞的棱长为acm,则a3×d×NA=4×(59+32)=4×91,a=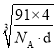 ,Ni、S原子最短核间距(D)为
,Ni、S原子最短核间距(D)为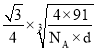 cm。
cm。

【题目】下表是一些烷烃的燃烧热,则下列表达正确的是
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A. 正戊烷的燃烧热大于3531.3 kJ·mol-1
B. 相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
C. 正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D. 甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
CO2(g) +2H2O(g) △H =-891.0kJ·mol-1