题目内容
11. (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)请回答下列问题:
①该反应的生成物能量总和小于(填“大于”、“小于”或“等于”)反应物能量总和.
②若2mol氢气完全燃烧生成水蒸气,则放出的热量<(填“>”、“<”或“=”)572kJ.
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点热值高,无污染.
(2)FeS2焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1;
H2O(g)═H2O(l)△H2=-44kJ•mol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g) )+H2O(g)=H2SO4(l)△H3=-152kJ/mol.
(3)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为12△H3+5△H2-2△H1.
(4)已知:在热力学标准状态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H).如图为氧族元素氢化物a、b、c、d的生成热数据示意图,试完成下列问题:
①写出氧族元素中含有18e的两种氢化物的电子式
 .
.②请你归纳:非金属元素氢化物的稳定性与氢化物的生成热△H的关系非金属元素氢化物越稳定,△H越小,反之亦然.
③写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
分析 (1)①反应物的能量低于生成物的能量,则反应吸热,反应物的能量高于生成物的能量,则反应放热;
②液态水变为水蒸气的过程是吸热的过程;
③根据反应产物和反应热分析;
(2)利用盖斯定律,将热化学方程式进行运算,计算反应的焓变;
(3)根据盖斯定律,利用方程式的加减得出C3H5(ONO2)3分解成CO2、N2、H2O、O2的化学方程式,其反应热也要相应的加减,从而得出其热化学反应方程式.
(4)①氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质;
②根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
③根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答 解:(1)①氢气燃烧生成液态水时放热,则反应物的能量高于生成物的能量,故答案为:小于;
②液态水变为水蒸气是吸热的过程,2mol氢气燃烧生成液态水时放出572kJ热量,生成气态水时放出的热量小于572kJ,故答案为:<;
③与化石燃料相比,利用氢能源有很多优点,燃烧产物为水无污染,燃烧热值高,故答案为:热值高,无污染;
(2)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
SO3(g) )+H2O(g)=H2SO4(l)△H3=-152kJ/mol,
故答案为:SO3(g) )+H2O(g)=H2SO4(l)△H3=-152kJ/mol;
(3)①6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③C(s)+O2(g)═CO2(g)△H3
由盖斯定律:5×②+12×③-2×①得:4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H=12△H3+5△H2-2△H1;
故答案为:12△H3+5△H2-2△H1;
(4)①氧族元素有O、S等元素,含有18e-的物质的有H2O2、H2S等物质,电子式分别为 ,故答案为:
,故答案为: ;
;
②非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
③由②可知,b为硒化氢的生成热数据,则硒化氢分解吸热,且△H=-81kJ/mol,所以H2S发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
点评 本题考查了化学反应的吸放热于反应物产物能量之间的关系、热化学方程式和盖斯定律的计算等知识,准确把握盖斯定律的概念是关键,注意知识的整理和应用,难度中等.

| A. | b+m+n | B. | b+m-n | C. | b-m+n | D. | b-m-n |
| A. | 人们常借助元素分析仪来确定有机化合物的组成 | |
| B. | 有机化合物的核磁共振氢谱可以帮助我们确定物质中氢原子的种类 | |
| C. | 根据对红外光谱的分析,可以初步判定该有机物中碳原子的种类 | |
| D. | 用质谱法对有机物进行分析,可以初步判断该有机物中具有哪些基团 |
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
| A. | 它与氧气接触即转变为SO3 | |
| B. | 亚硫酸钙能溶解于它的水溶液中 | |
| C. | 它的密度比空气小,且不易液化 | |
| D. | 它的水溶液是酸性,且能被强氧化剂氧化 |
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H3<0 | B. | △H2>0,△H4>0 | C. | △H2=△H1+△H3 | D. | △H3=$\frac{V{H}_{4}+2V{H}_{5}}{3}$ |
| A. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 其水溶液显强酸性,俗称石炭酸 |
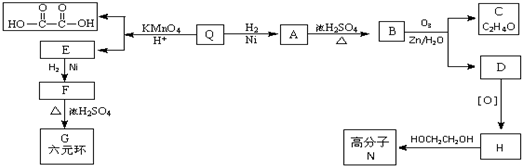
 ;Q的反式结构简式是
;Q的反式结构简式是 .
. .
. K2S
K2S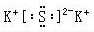 NaOH
NaOH
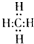 ,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.
,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.