题目内容
3.下列关于苯酚的叙述中,错误的是( )| A. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 其水溶液显强酸性,俗称石炭酸 |
分析 A、苯酚酸性小于碳酸酸性,不会生成二氧化碳气体;
B、苯酚若不慎沾在皮肤上,应立即用酒精擦洗;
C、苯酚在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶;
D、苯酚水溶液显弱酸性,俗称石炭酸;
解答 解:A、由于苯酚酸性小于碳酸酸性,在碳酸氢钠溶液中滴入苯酚的水溶液,不会生成二氧化碳气体,故A正确;
B、苯酚有腐蚀性,苯酚若不慎沾在皮肤上,应立即用酒精擦洗,因为苯酚易溶于乙醇,乙醇五毒且乙醇具有挥发性,故B正确;
C、由于苯酚在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶,故C正确;
D、由于苯酚水溶液显弱酸性,酸性比碳酸还弱,俗称石炭酸,故D错误;
故选D.
点评 本题考查学生苯酚的物理性质,可以根据所学知识来回答,属于基本知识的考查,较简单.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
14.下列说法中,正确的是( )
| A. | 甲醇、乙二醇、丙三醇都易溶于水且都有剧毒 | |
| B. | 按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高 | |
| C. | 相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多 | |
| D. | 甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应 |
18.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物.
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
8.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.
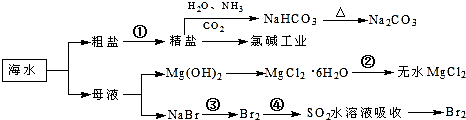
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
15.2SO2(g)+O2(g) $?_{△}^{V_{2}O_{5}}$ 2SO3(g)△H<0是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
12.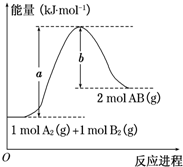 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 |
 (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l) .
.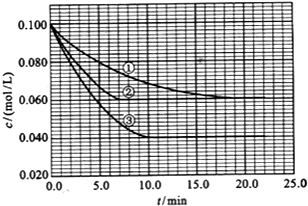 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题: