题目内容
19.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度.下列关于电负性的变化规律正确的是( )| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
分析 元素的非金属性越强,电负性越大,元素的金属性越强,电负性越小,结合同周期、同主族元素性质的递变规律分析.
解答 解:A、周期表中从左到右非金属性逐渐增强,所以主族元素的电负性逐渐变大,故A正确;
B、周期表中从上到下,金属性增强,所以同一主族元素的电负性逐渐减小,故B错误;
C.元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,金属性越弱,故C错误;
D.元素的电负性越大,越易得电子,元素的非金属性越强,元素的电负性越小,则元素的非金属性越弱,故D错误;
故选A.
点评 本题考查了电负性的含义,题目难度不大,注意把握电负性与非金属性的关系.

练习册系列答案
相关题目
9.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 标准状况下,22.4L CCl4含有个NA个CCl4分子 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
10.下列各组离子能共存的是( )
| A. | Na+、OH-、Al3+、SO42- | B. | Fe3+、SCN-、Na+、Cl- | ||
| C. | Mg2+、SO42-、Na+、Cl- | D. | H+、Cl-、NO3-、Fe2+ |
14.下列说法中,正确的是( )
| A. | 甲醇、乙二醇、丙三醇都易溶于水且都有剧毒 | |
| B. | 按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高 | |
| C. | 相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多 | |
| D. | 甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应 |
8.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.
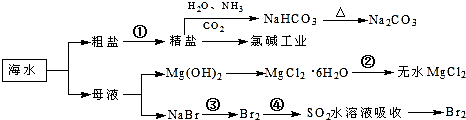
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
 (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l) .
.