题目内容
1.(1)请写出以下物质的电子式:CO2 K2S
K2S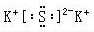 NaOH
NaOH
(2)我国已启动的“西气东输”工程,其中的“气”是指天然气,其主要成分的分子式是CH4,电子式为
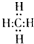 ,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.
,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.(3)硒(Se)是人体必需微量元素.已知在周期表中,硒与氧同主族,与钙同周期,试回答下列问题:
①硒位于周期表第4周期,VIA族;
②硒的最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4.
分析 (1)二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;硫化钾为离子化合物,必须标出阴阳离子所带电荷,阴离子需要标出最外层电子;NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合;
(2)天然气的主要成分是CH4,根据甲烷中碳原子要形成4对共用电子对,氢原子要形成1对共用电子对,得出电子式,甲烷分子中碳原子处于正四面体的中心,4个H原子处处于正四面体的四个顶角;根据烷烃的通式CnH2n+2来计算m值,根据分子式分析它的同分异构体;
(3)①硒是第VIA族元素;②根据最外层电子数分析最高化合价,然后书写最高价氧化物对应的水化物化学式;
解答 解:(1)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ; 硫化钾为离子化合物,有钾离子和硫离子构成,其电子式为:
; 硫化钾为离子化合物,有钾离子和硫离子构成,其电子式为: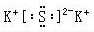 ;NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为
;NaOH是由钠离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为 ,
,
故答案为: ;
;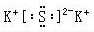 ;
; ;
;
(2)天然气的主要成分是CH4,因甲烷中碳原子要形成4对共用电子对,氢原子要形成1对共用电子对,甲烷的电子式为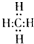 ,因甲烷分子中碳原子处于正四面体的中心,4个H原子处处于正四面体的四个顶角,所以分子里各原子的空间分布呈正四面体,烷烃的通式为:CnH2n+2,化学式为C4Hm的烷烃,将n=4带入2n+2得,m=10,分子式为C4H10;丁烷有CH3CH2CH2CH3、(CH3)2CHCH3两种同分异构体,
,因甲烷分子中碳原子处于正四面体的中心,4个H原子处处于正四面体的四个顶角,所以分子里各原子的空间分布呈正四面体,烷烃的通式为:CnH2n+2,化学式为C4Hm的烷烃,将n=4带入2n+2得,m=10,分子式为C4H10;丁烷有CH3CH2CH2CH3、(CH3)2CHCH3两种同分异构体,
故答案为:CH4;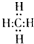 ;正四面体;10;CH3CH2CH2CH3、(CH3)2CHCH3;
;正四面体;10;CH3CH2CH2CH3、(CH3)2CHCH3;
(3)①硒是第VIA族元素,硒位于周期表第4周期,VIA族,
故答案为:4;VIA;
②最高化合价=最外层电子数=6,最高价氧化物的化学式为SeO3,对应水化物的化学式为H2SeO4,
故答案为:SeO3;H2SeO4.
点评 本题考查电子式的书写、天然气的主要成分CH4有关知识、元素周期表的结构等,题目难度中等,注意书写电子式未成键的孤对电子对容易忽略,注意烷烃通式在确定烷烃分子式时的应用,试题有利于培养学生灵活应用所学知识的能力.

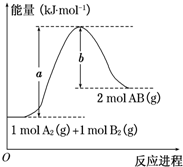 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 |
| A. | 17gNH3含有10nA个质子 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 1mol C2H6含有6nA个共价键 | |
| D. | 1mol 金属K被完全氧化生成KO2,失去2nA个电子 |
| A. | 2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 3,4─二甲基戊烷 | D. | 3─甲基己烷 |
 (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l) .
.

 (R为烃基)
(R为烃基) 不能发生催化氧化反应.
不能发生催化氧化反应.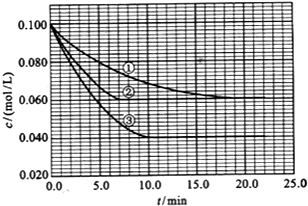 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题: