题目内容
16.已知:C(s)+O2(g)=CO2(g)△H1CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H3<0 | B. | △H2>0,△H4>0 | C. | △H2=△H1+△H3 | D. | △H3=$\frac{V{H}_{4}+2V{H}_{5}}{3}$ |
分析 A、发光放热的剧烈的氧化还原反应为燃烧;
B、以碳、CO或H2为还原剂的氧化还原反应为吸热反应,燃烧均为放热反应;
C、一个反应无论是一步完成还是分为数步完成,其热效应是相同的;
D、根据目标反应,将所给的条件反应中的计量数做相应的变化,然后做加、碱或乘除即可得目标反应.
解答 解:A、发光放热的剧烈的氧化还原反应为燃烧,故煤炭的燃烧为放热反应,故△H1<0,△H3<0,故A错误;
B、以碳、CO或H2为还原剂的氧化还原反应为吸热反应,故△H2>0,;燃烧均为放热反应,故铁在氧气中燃烧是放热的,即△H4<0,故B错误;
C、一个反应无论是一步完成还是分为数步完成,其热效应是相同的,
②CO2(g)+C(s)=2CO(g)△H2
③2CO(g)+O2(g)=2CO2(g)△H3
将②+③相加可得:C(s)+O2(g)=CO2(g)△H1 故应有:△H1=△H2+△H3,故C错误;
D、已知:④4Fe(s)+3O2(g)=2Fe2O3(s)△H4
2 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
将$\frac{④}{3}+\frac{2×⑤}{3}$可得:2CO(g)+O2(g)=2CO2(g) 故△H3=$\frac{④+2×⑤}{3}$,故D正确.
故选D.
点评 本题考查了反应吸放热的判断和根据盖斯定律来解题,应注意的是一个反应无论是一步完成还是分为数步完成,其热效应是相同的.

练习册系列答案
相关题目
6.现有化合物:
甲: 乙:
乙: 丙:
丙:
(1)请判别上述哪些化合物互为同分异构体(填编号):甲乙丙.
(2)请分别写出鉴别甲、乙、丙化合物的方法.(指明所选试剂及主要现象即可)
甲:
 乙:
乙: 丙:
丙:
(1)请判别上述哪些化合物互为同分异构体(填编号):甲乙丙.
(2)请分别写出鉴别甲、乙、丙化合物的方法.(指明所选试剂及主要现象即可)
| 试剂 | 现象 | |
| 甲 | 浓溴水或FeCl3溶液 | 白色沉淀或溶液变紫色 |
| 乙 | 碳酸氢钠溶液 | 气体生成 |
| 丙 | 银氨溶液或Cu(OH)2 | 银镜或砖红色沉淀 |
8.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.
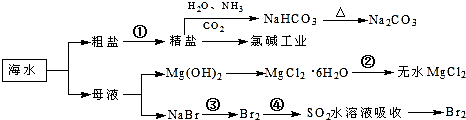
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
 (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l) .
.
 (R为烃基)
(R为烃基) 不能发生催化氧化反应.
不能发生催化氧化反应.