题目内容
8.实验室测定溶液中RO3-浓度的方法之一是:取25mL待测液于锥形瓶中,加入足量的KI溶液,发生反应①.充分反应后,往锥形瓶中滴入2-3滴淀粉溶液,用0.001mol/L的Na2S2O3溶液滴定,发生反应②.反应方程式如下:反应①aRO3-+bI-+cH+=dR-+eI2+fH2O
反应②I2+2Na2S2O3=2NaI+Na2S4O6
下列说法正确的是( )
| A. | b=c | |
| B. | R元素位于周期表的ⅤA族 | |
| C. | 滴定终点时,溶液的颜色由无色变为蓝色 | |
| D. | 若滴定消耗Na2S2O3溶液20.00mL,则反应①转移电子6.02×1020个 |
分析 A.aRO3-+bI-+cH+=dR-+eI2+fH2O,由原子守恒及电子守恒、电荷守恒可知,反应为RO3-+6I-+6H+=R-+3I2+3H2O;
B.由选项A可知,R的最低价为-1价,则最外层有7个电子;
C.锥形瓶中滴入2-3滴淀粉溶液,溶液为蓝色,用0.00mol/L的Na2S2O3溶液滴定,发生反应②;
D.由RO3-+6I-+6H+=R-+3I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6可知,6e-~3I2~6Na2S2O3,以此计算.
解答 解:A.aRO3-+bI-+cH+=dR-+eI2+fH2O,由原子守恒及电子守恒、电荷守恒可知,反应为RO3-+6I-+6H+=R-+3I2+3H2O,则b=c=6,故A正确;
B.由选项A可知,R的最低价为-1价,则最外层有7个电子,则R元素位于周期表的ⅤⅡA族,故B错误;
C.锥形瓶中滴入2-3滴淀粉溶液,溶液为蓝色,用0.00mol/L的Na2S2O3溶液滴定,发生反应②,则滴定终点时,溶液的颜色由蓝色变为无色,故C错误;
D.由RO3-+6I-+6H+=R-+3I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6可知,6e-~3I2~6Na2S2O3,则滴定消耗Na2S2O3溶液20.00mL,其物质的量为0.001mol/L×0.02L=2×10-5mol,则反应①转移电子2×10-5×6.02×1023个,故D错误;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中化合价变化、物质的量与转移电子的关系及滴定原理应用为解答的关键,侧重分析、计算能力的考查,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
18.下列实验不合理的是( )
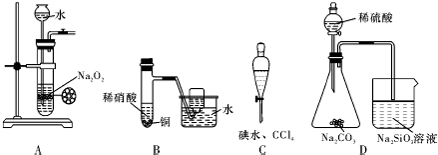

| A. | 制备少量氧气 | B. | 制备并收集少量NO气体 | ||
| C. | 四氯化碳萃取碘水中的碘 | D. | 证明非金属性强弱:S>C>Si |
3.下列关于有机物的说法中正确的是( )
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
13.有两组物质:①组CH4、聚乙烯、邻二甲苯 ②组2-丁烯、乙炔、苯乙烯下列有关上述有机物说法正确的是
( )
( )
| A. | ①组物质都不能使酸性高锰酸钾褪色,②组物质都能使酸性高锰酸钾褪色 | |
| B. | ①组物质都不能使溴的四氯化碳褪色,②组物质都能使溴的四氯化碳褪色 | |
| C. | ②组物质所有原子可以在同一平面内 | |
| D. | 邻二甲苯的一氯代物只有两种 |
17.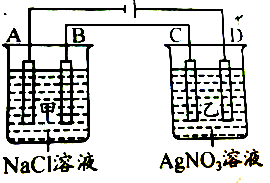 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
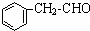 )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90.
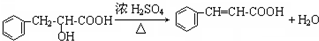
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90. $\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E
$\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E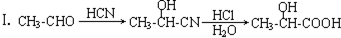
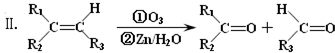
 ;该反应类型属消去反应.
;该反应类型属消去反应.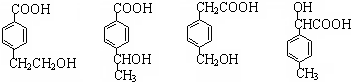 任意一种.
任意一种.
 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
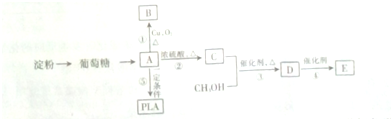
.
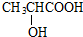 C中所含官能团的名称是羧基、碳碳双键
C中所含官能团的名称是羧基、碳碳双键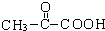 +2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$
+2H2O反应④的化学方程式为n CH2=CHCOOCH3$\stackrel{催化剂}{→}$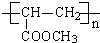
 +(n-1)H2O
+(n-1)H2O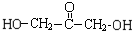 、
、 .
.