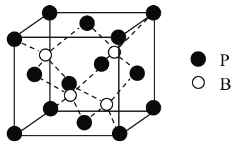
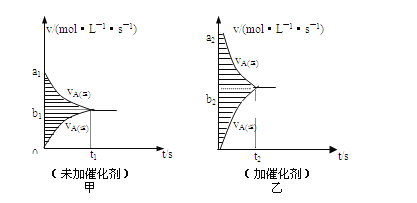
题目内容
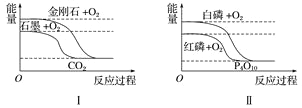
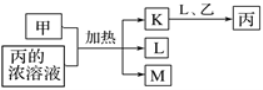
【题目】短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )
A.Y、Z、W三种元素电负性:W>Z>Y
B.Y、Z、W三种元素第一电离能:Z>W>Y
C.L的沸点一定比X、Y组成的化合物沸点高
D.由X、Y、Z、W构成的化合物中只能含有共价键
【答案】CD
【解析】
K是红棕色气体,丙的浓溶液具有强氧化性,得出K为二氧化氮,丙为硝酸,乙为氧气,L为水,甲是单质,与硝酸反应生成M,M为氧化物,则M为二氧化碳,因此X为H,Y为C,Z为N,W为O。
A. 同周期从左到右电负性逐渐增大,因此Y、Z、W三种元素电负性:W>Z>Y,故A正确;
B. 同周期从左到右第一电离能呈增大趋势,第IIA族大于第IIIA族,第VA族大于第VIA族,因此Y、Z、W三种元素第一电离能:Z>W>Y,故B正确;
C. L的沸点一定不一定比X、Y组成的化合物沸点高,水的沸点可能低于碳原子数比较大的烃的沸点,故C错误;
D. 由X、Y、Z、W构成的化合物中可能含有共价键,也可能形成离子键,比如碳酸氢铵,故D错误。
综上所述,答案为CD。

【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
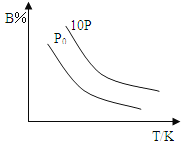
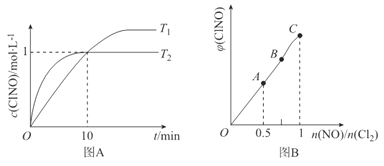
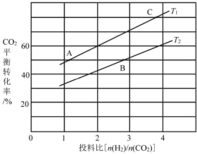
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
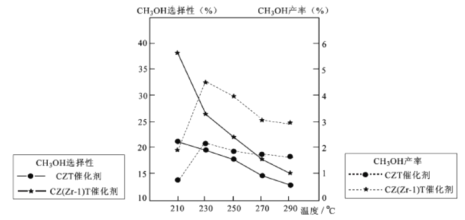
①温度高于230℃,CH3OH产率随温度升高而下降的原因是________。
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
【题目】甘氨酸亚铁络合物[(NH2CH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:

已知:
甘氨酸(NH2CH2COOH ) | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4.7H2O | FeCl2.4H2O |
易溶入水 | 易溶于水和乙醇 | 易溶于水 | 易溶于水 | 易溶于水 |
微溶于乙醇 | 有弱酸性和强氧化性 | 难溶于乙醇 | 难溶于乙醇 | 易溶于乙醇 |
请回答:
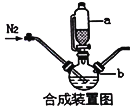
(1)合成装置中仪器b的名称是____________
(2)合成过程中,为了防止亚铁被氧化,本实验中采取的措施是____________
(3)下列说法正确的是____________
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ、步骤Ⅳ都有固液分离,可采用常压过滤,也可采用减压过滤
D.粗产品提纯操作为重结晶,过滤,洗涤,干燥,其中干燥过程最好选用真空干燥
(4)合成过程需控制pH=5.5,pH过低或过高都会使产率下降,试说明理由_________________
(5)步骤Ⅲ加入无水乙醇的目的是___________________________________________________
(6)产品纯度可用“凯氏定氮法”测定,测定过程分为以下四步:
I、将有机氮转换为硫酸铵 II、将铵盐转化为氨气蒸出
III、用试剂吸收氨气 IV、滴定
①以下装置可以完成II,III两步操作
②将下列操作按合理顺序排入:
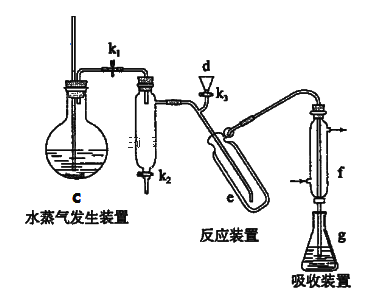
仪器清洗后,在g中加入吸收剂,然后将第I步获得的铵盐试样由d注入e→(_________)→(_________)→(_________)→(_________)→使水蒸气进入e,蒸馏几分钟后,将f下端提离液面并用少量蒸馏水洗涤清洗管口,停止加热c ,移去锥形瓶,立即用标准盐酸溶液进行滴定。
A.打开k1 B.关闭k3、k2 C.加热c D.由d注入氢氧化钠溶液,蒸馏水冲洗,并留少量液体作水封
②关于滴定过程下列说法正确的是____________
A.滴定管必须经检漏、洗涤、润洗后才能使用
B.标准盐酸溶液装入滴定管后,发现下端有气泡,可将橡皮管稍向上弯曲,挤压玻璃珠,气泡可被流水带出
C.滴定刚开始时,左手可以离开旋塞,让溶液自然流下
D.因为本测定方法较为精密和准确而操作过程繁琐,故产品纯度测定一次就可