题目内容
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
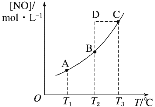
A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
【答案】D
【解析】
A.根据图像可知,随着温度的升高,NO的物质的量浓度增大,说明平衡逆向移动,则正反应为放热反应,故A错误;
B.由于正反应为放热反应,温度越高,平衡常数越小,则K1>K2,故B错误;
C.根据图像可知,由状态D到平衡点B,需要减小NO的浓度,所以反应正向进行,则v正>v逆,故C错误;
D.由于反应物碳是固体,所以在反应进行过程中,气体的总质量一直在变,V一定,气体的密度也就一直在变,当若混合气体的密度不再变化,则可以判断反应达到平衡状态C,故D正确;
答案:D

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①![]()
![]()
②![]()
![]()
③断裂![]() 气体中的化学键需要吸收1076kJ的能量,断裂
气体中的化学键需要吸收1076kJ的能量,断裂![]() 气体中的化学键需要吸收1490kJ的能量。
气体中的化学键需要吸收1490kJ的能量。
请回答:
(1)断裂![]() 中所有化学键需要吸收的能量为________kJ。
中所有化学键需要吸收的能量为________kJ。
(2)T1℃时,向密闭容器中加入一定量的![]() 和C,发生反应①,达到平衡后
和C,发生反应①,达到平衡后![]() 的浓度为
的浓度为![]() ;其他条件不变,缩小容器体积,再次达到平衡时,
;其他条件不变,缩小容器体积,再次达到平衡时,![]() 的浓度为
的浓度为![]() ,则a________b(选填“>”“<”或“=”)。
,则a________b(选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的![]() 和CO发生反应②,测得相关数据如表所示:
和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
|
|
| |||
1 | 恒温 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒温 | 2 | 3 | M | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1=_______。
②容器2中,5min达到平衡,则0~5min以![]() 表示该反应的速率
表示该反应的速率![]() ___________。
___________。
③对于三个容器中的反应,下列说法正确的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡转化率
的平衡转化率![]()
C.![]() D.平衡时气体压强:
D.平衡时气体压强:![]()
(4)一定条件下,向恒压密闭容器中充入0.5mol ![]() 和1.0mol CO,发生反应②,CO和
和1.0mol CO,发生反应②,CO和![]() 的物质的量浓度(c)与时间(t)的关系如图所示:
的物质的量浓度(c)与时间(t)的关系如图所示:

①6min时改变的外界条件为________________。
②若在6min时,恒温将容器体积扩大到10L,请在图中画出6~10min![]() 的物质的量浓度随时间变化的曲线_________。
的物质的量浓度随时间变化的曲线_________。
