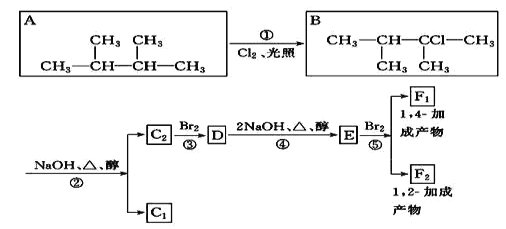
题目内容
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(Ni0.1Co0.9P)。回答下列问题:
(1)Co在元素周期表中的位置为_______,Co2+价层电子排布式为_______。
(2)Co、Ni可形成[Co(NH3)6]Cl2、K3[Co(NH3)6]、Ni(CO)4、[Ni(NH3)6]SO4等多种配合物。
①SO42-的空间构型为_____,NO3-中N原子的杂化轨道类型为_______。
②C、N、O、S四种元素中,第一电离能最大的是_______。
③1 mol [Co(NH3)6]Cl2中含有σ键的数目为______;已知NF3比NH3的沸点小得多,试解释原因_______。
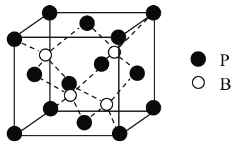
(3)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为ρ g·cm-3,计算晶体中硼原子和磷原子的最近核间距为________cm。
【答案】第四周期Ⅷ族 3d7 正四面体 sp2杂化 N 24NA NH3分子间存在氢键,作用力大 ![]() ×
×
【解析】
(1)根据钴元素的原子序数为27,利用构造原理可确定其核外电子排布,从而确定其在周期表中的位置,Co原子失去最外层2个电子得到Co2+离子,进而可确定其价层电子排布式;
(2)①根据离子的中心原子的价层电子对数确定中心原子的杂化类型以及离子的空间结构;
②根据同周期元素的第一电离能从左到右递增,同主族元素第一电离能从上到下递减,同时注意IIA、VA族的特殊性判断;
③结合粒子的组成,N-H单键和配位键都是σ键;分子晶体的熔沸点与相对分子质量有关,存在氢键的熔沸点异常高;
(3)通过晶胞的结构确定晶胞的组成,确定晶胞的质量,结合晶胞的密度,可以求出晶胞参数,晶体中硼原子和磷原子的最近核间距为晶胞体对角线的![]() ,体对角线长度为晶胞边长的
,体对角线长度为晶胞边长的![]() 倍,得出晶体中硼原子和磷原子的最近核间距。
倍,得出晶体中硼原子和磷原子的最近核间距。
(1)Co是27号元素,在周期表中处在第四周期第VIII族,其核外电子排布为[Ar]3d74s2,Co原子失去最外能层上的2个4s电子形成Co2+,则Co2+离子的价层电子排布式为3d7;
(2)①SO42-中S原子以sp3杂化轨道成键、该离子中存在4个σ键,因此SO42-离子空间构型为正四面体形;NO3-中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2杂化;
=3,N原子轨道的杂化类型为sp2杂化;
②C、N、O、S四种元素中,C、N、O是同一周期元素,元素的第一电离能随原子序数的增大呈增大趋势,但是N原子2p轨道处于半满状态的稳定状态,失去电子消耗能量比O大,故其第一电离能大于O元素;O、S同一主族元素,同主族元素从上到下第一电离能逐渐减小,故四种元素中第一电离能最大的是N;
③[Co(NH3)6]Cl2中配位体NH3中的N-H键是σ键,Co原子与N原子之间存在配位键是σ键,1个[Co(NH3)6]Cl2中含有24个σ键,则1 mol该物质中含有24 molσ键;
NF3与NH3均为分子构成的物质,氨气分子间存在氢键导致其沸点反常的高;
(3)由图可知,1个晶胞中含有4个B原子,含有P原子数目为8×![]() +6×
+6×![]() =4个,故晶胞质量m=
=4个,故晶胞质量m=![]() g,设边长为a cm,则晶胞的体积V=a3 cm3,故晶胞密度ρ=
g,设边长为a cm,则晶胞的体积V=a3 cm3,故晶胞密度ρ=![]() gcm3,解得a=2×
gcm3,解得a=2× cm。晶体中硼原子和磷原子的最近核间距为晶胞体对角线的
cm。晶体中硼原子和磷原子的最近核间距为晶胞体对角线的![]() ,体对角线长度为晶胞边长的
,体对角线长度为晶胞边长的![]() 倍,所以晶体中硼原子和磷原子的最近核间距=
倍,所以晶体中硼原子和磷原子的最近核间距=![]() ×2×
×2× cm=
cm=![]() ×
× cm。
cm。

 名校课堂系列答案
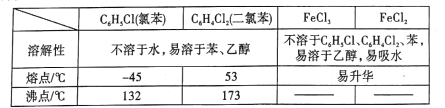
名校课堂系列答案【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为____________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
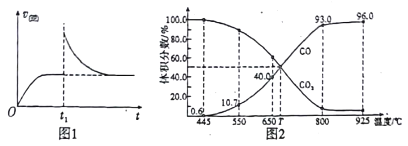
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是______。(计算时不考虑温度对△H的影响)
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如图3所示( 导电壳内部为纳米零价铁)。
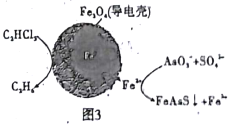
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。