题目内容
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
BC
解析试题分析:A项不满足物料守恒,错误;B项满足电荷守恒,正确;C项反应生成等量的KHCO3、KCl,HCO3-的水解程度大于其电离程度,溶液呈弱碱性,正确;D项先假设NH4HSO4与NaOH等量反应,形成等量的Na+、NH4+、SO42-,但由于少量NH4+水解溶液显弱酸性,故略多点NaOH即可满足溶液呈中性,即c(Na+)>c(SO42-)>c(NH4+)>c(OH-) =c(H+),该项错误。
考点:考查离子浓度大小的比较。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
| A.2. 3×10-7mol·L-1 | B.4. 6×10-7mol·L-1 |
| C.9. 2×10-7mol·L-1 | D. ×10-3mol·L-1 ×10-3mol·L-1 |
下列说法正确的是
| A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子 |
| B.强电解质的水溶液导电性强于弱电解质的水溶液 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.强电解质易溶于水,弱电解质难溶于水 |
下列溶液中离子浓度大小关系错误的是
A.0.1 mol/L的NH4Cl溶液中: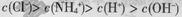 |
B.0.1mol/L的CH3COONa溶液中: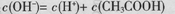 |
C.0.1 mol/LNa2S的溶液中: |
D.pH=2的盐酸与pH=12的氨水等体积混合后: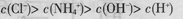 |
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是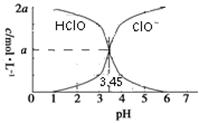
| A.当pH=2时,溶液中c(ClO-)>c(Na+) |
| B.当c(ClO-)>c(HClO)时,溶液一定呈碱性 |
| C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应 |
| D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1 |
下列说法或表达正确的是
| A.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有: C(Na+)-c(CH3COO-)=c(OH-)-c(H+) |
| B.向ZnS白色悬浊液中加入CuSO4溶液,有黑色沉淀产生,是因为Ksp (ZnS)<Ksp (CuS) |
| C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可以制备Fe(OH)3胶体 |
| D.热水中加入NaCl溶解至饱和后溶液的pH等于7 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
常温下,浓度均为0.1mol/L的溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.05mol/L |
| D.①和③等体积混合后的溶液pH>7:c(NH4+)>c(Cl—)>c(OH-)>c(H+) |