题目内容
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
| A.2. 3×10-7mol·L-1 | B.4. 6×10-7mol·L-1 |
| C.9. 2×10-7mol·L-1 | D. ×10-3mol·L-1 ×10-3mol·L-1 |
C
解析试题分析:生成CaC2O4沉淀所需要在溶液的离子浓度积必须大于Ksp,即c(Ca2+)·c(C2O42-)>Ksp。因为是将等体积的CaCl2溶液与Na2C2O4溶液混合,混合溶液的离子浓度比原溶液的浓度小一倍,即有0.5×10-2 c(C2O42-)/2>2.3×10-9,c(C2O42-)="9." 2×10-7mol·L-1。
考点:难溶物的Ksp的计算方法。

练习册系列答案
相关题目
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
| A.对比等浓度的两种酸的pH |
| B.对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
常温下,已知0.1mol·L-1的CH3COOH和HCN溶液的PH分别为a、b,且1<a< b。下列有关叙述不正确的是( )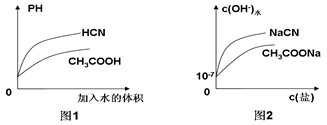
| A.常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 |
| B.在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-) |
| C.相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 |
| D.常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示 |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.加热稀醋酸溶液其pH 稍有减小 |
| C.明矾净水 | D.浓的硫化钠溶液有臭鸡蛋气味 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 |
C.2NO+2CO 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
下列溶液一定呈中性的是( )
| A.c(H+)=c(OH-)=10-6mol/L溶液 | B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 | D.酸与碱恰好完全反应生成正盐的溶液 |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
下列说法正确的是
A.将25℃纯水加热至95℃时,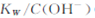 增大 增大 |
B.将pH=11的Na2CO3溶液加水稀释, 增大 增大 |
| C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14" |
| D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则 |
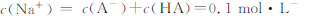
在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO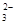 ) ) | B.c(OH-)=2c(H+) |
C.c(HCO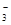 )>c(H2CO3) )>c(H2CO3) | D.c(Na+)<c(CO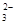 )+c(HCO )+c(HCO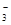 ) ) |