题目内容
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是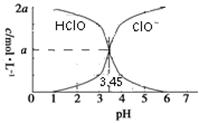
| A.当pH=2时,溶液中c(ClO-)>c(Na+) |
| B.当c(ClO-)>c(HClO)时,溶液一定呈碱性 |
| C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应 |
| D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1 |
AD
解析试题分析:A、当pH=2时,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒,有c(ClO-)+c(OH-)=c(H+)+c(Na+),所以c(ClO-)>c(Na+),正确;B、由图可知当c(ClO-)>c(HClO)时,溶液可能呈酸性,错误;C、当pH=3.45时,c(HClO)=c(ClO-)=amol/L,溶液中仍存在大量HClO,说明所加NaOH溶液与HClO未完全反应,错误;D、根据物料守恒得c(HClO)+c(ClO-)=2amol/L,再根据电荷守恒有c(ClO-)+c(OH-)=c(H+)+c(Na+),二者结合得c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1,正确,答案选AD。
考点:考查混合溶液中离子浓度的比较,守恒规律的应用,溶液酸碱性的判断

下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.加热稀醋酸溶液其pH 稍有减小 |
| C.明矾净水 | D.浓的硫化钠溶液有臭鸡蛋气味 |
在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,则它们的物质的量浓度由大到小的顺序是
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
常温下,将0.1mol/L的醋酸和0.1mol/L的NaOH溶液等体积混合,所得溶液中不存在的关系是
| A.c(OH-)>c(H+) |
| B.c(CH3COOH)>c(CH3COO-) |
| C.c(Na+)>c(CH3COO-) |
| D.c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-) |
在55℃时,下列说法正确的是
| A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 |
| B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L |
| C.饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| D.0.1mol/L的(NH4)2SO4溶液中:c(NH4+) > c(SO42-) > c(H+) > c(OH-) |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是
| A.水是弱电解质 | B.可燃冰是可以燃烧的水 |
| C.氢氧两种元素只能组成水 | D.0℃时冰的密度比液态水的密度大 |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |