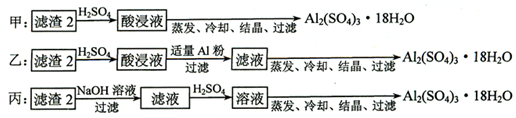
题目内容
6.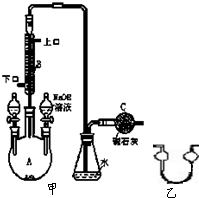 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:(1)反应开始前已向仪器 A 的名称是三颈烧瓶.装在左侧分液漏斗中的药品是苯与液溴混合液.右侧分液漏斗中的物质的作用是洗涤溴苯或除去溴苯中溶解的液溴与三溴化铁.
(2)为了验证此反应式取代反应,甲同学,向锥形瓶中的液体加入AgNO3溶液,有淡黄色沉淀产生.乙同学认为,生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果不可靠,要除去混在HBr中的溴蒸气.在B与锥形瓶之间连接一个如图所示的装置,你认为该装置中可以加入苯或CCl4液体.
分析 (1)根据仪器的形状确定名称;制额备溴苯使用的反应物是苯、液溴,铁做催化剂,据此回答反应器中的药品,
苯和液溴反应的产物喝和水是互溶的;
(2)除去溴单质,但是不影响HBr的检验,可以采用溴单质溶于有机溶剂的明显颜色变化来进行.
解答 解:(1)仪器A的名称是三颈烧瓶,装在左侧分液漏斗中的药品是反应物苯和液溴,右侧分液漏斗中的物质水的作用是洗涤溴苯或除去溴苯中溶解的液溴与三溴化铁,以制得较纯的溴苯,故答案为:三颈烧瓶;苯和液溴混合液;洗涤溴苯或除去溴苯中溶解的液溴与三溴化铁;
(2)除去混在HBr中的溴蒸气,可以用苯或CCl4,溴单质在其中的溶解度很大,但是HBr不溶于其中,故答案为:苯或CCl4.
点评 本题考查了溴苯的制备方法,注重了基础知识考查,根据所学知识完成即可,本题难度不大.

练习册系列答案
相关题目
14.下列离子方程式书写正确的是( )
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生产I2:IO3-+5I-+3H2O=3I2+6OH- | |
| B. | FeSO4溶液中加入酸性K2Cr2O7溶液:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ | |
| D. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
11.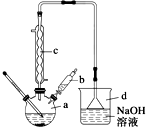 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器d的作用是吸收HBr防污染.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.