题目内容
16.现有0.1mol•L-1的Na2SO4和0.2mol•L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol•L-1的 Ba(OH)2溶液,并不断搅拌,使反应充分进行.(1)当加入100mLBa(OH)2溶液时,所得溶液中的溶质是Na2SO4,其物质的量浓度为0.05mol•L-1.
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为150mL,所得溶液中溶质为NaOH,其物质的量浓度为0.08mol•L-1.
分析 (1)反应相当于Ba(OH)2先与H2SO4反应,然后再Na2SO4与氢氧化钡反应,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.1moL•L-1=0.01mol,故氢氧化钡与硫酸反应一半,硫酸钠反应一半,根据n=cV计算硫酸钠的物质的量,再根据m=nM计算硫酸钠的质量;
(2)溶液中沉淀量达到最大时,发生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-),再根据V=$\frac{n}{V}$计算氢氧化钡的体积,溶液中溶质为NaOH,根据钠离子守恒可知n(NaOH)=n(Na+),再根据c=$\frac{n}{V}$计算.
解答 解:(1)反应相当于Ba(OH)2先与H2SO4反应,然后再Na2SO4与氢氧化钡反应,100mLBa(OH)2溶液中n[Ba(OH)2]=0.1L×0.2moL•L-1=0.02mol,100mL溶液中n(H2SO4)=0.1L×0.2moL•L-1=0.02mol,故氢氧化钡与硫酸恰好,硫酸钠不反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2 H2O,溶液中溶质为Na2SO4,Na2SO4的物质的量为0.1L×0.1moL•L-1=0.01mol,Na2SO4的浓度=$\frac{0.01mol}{0.2L}$=0.05mol/L,
故答案为:Na2SO4;0.05;
(2)溶液中沉淀量达到最大时,硫酸根完全反应,发生Ba2++SO42-=BaSO4↓,故n[Ba(OH)2]=n(SO42-)=0.01mol+0.02mol=0.03mol,故氢氧化钡溶液的体积为$\frac{0.03mol}{0.2mol/L}$=0.15L=150mL.
此时溶液中溶质为NaOH,根据钠离子守恒可知n(NaOH)=n(Na+)=0.01mol×2=0.02mol,故溶液中NaOH浓度为=$\frac{0.02mol}{0.25L}$=0.08mol/L,
故答案为:150;NaOH;0.08.
点评 本题考查混合物的有关计算、常用化学计量的有关计算等,难度中等,理解发生反应的本质和元素守恒是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量⑧混合气体的总体积.
| A. | ①③④⑤ | B. | ①②③④⑤⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
①合金的硬度一般比它的各成分金属的大
②一般合金的熔点比它的各成分金属的更低
③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
⑥合金只可能是由两种或两种以上的金属熔合而成的具有金属特性的物质
⑦生铁和钢都是铁、碳合金,它们在性能和用途上差别不大.
| A. | ①②③⑤ | B. | ①②③⑤⑥⑦ | C. | ①②④⑤ | D. | 全部 |

| A. | 分子式为C21H20O3Cl2 | |
| B. | 醚键上的氧原子至少与另外11个原子共面 | |
| C. | 分子中不存在手性碳原子 | |
| D. | 在一定条件下可发生加成、取代、氧化反应 |
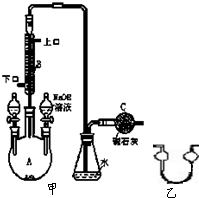 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: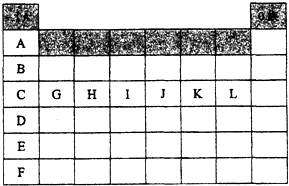 如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)
如图是元素周期表中各主族(A)及零族的部分元素符号代码(阴影处为族序数)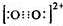 .CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体
.CaC2晶胞结构与氯化钠晶体相似,则在晶体中与钙离子距离最近的C22-数目为6,这些C22-在空间所围成的几何图形为正八面体