题目内容
1.信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:请回答下列问题:

(1)第①步Cu与酸反应的离子方程式为Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+,使用H2O2的优点是不引入杂质,对环境无污染;
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是在坩埚中加热脱水(填仪器名称和操作方法).
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
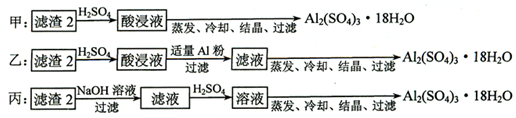
上述三种方案中,甲方案不可行,从原子利用率角度考虑,乙方案更合理.
(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
在往滴定管中装入标准液之前,滴定管应该先经过检验是否漏水,再用水清洗干净,
然后再标准液润洗,方可装入标准液.排除酸式滴定管尖嘴处气泡的方法是快速放出液体.在滴定时,左手操作滴定管活塞.
(6)写出计算CuSO4•5H2O质量分数的表达式(要求带单位)ω=$\frac{c×b×10{\;}^{-3}×250×5}{a}$;
(7)下列操作会导致CuSO4•5H2O含量的测定结果偏高的有cd.
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
d.读取滴定管中待测液的初始体积时仰视.
分析 (1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水;
(4)依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)滴定管使用之前应该先经过检验是否漏水,再用水清洗干净,然后再用标准液润洗,方可装入标准液.排除酸式滴定管尖嘴处气泡的方法是快速放出液体,在滴定时,左手操作滴定管活塞;
(6)依据滴定实验和反应离子方程式计算得到;
(7)滴定实验误差分析依据标准溶液消耗的多少进行分析判断.
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;
故答案为:Cu+4H++2NO3-$\frac{\underline{\;加热\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;加热\;}}{\;}$3Cu2++2NO↑+4H2O;
(2)过氧化氢做氧化剂不引入杂质,对环境无污染,故答案为:不引入杂质,对环境无污染;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,故答案为:在坩埚中加热脱水;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费;
故答案为:甲;乙;
(5)滴定管使用之前应该先经过检验是否漏水,再用水清洗干净,然后再用标准液润洗,方可装入标准液.排除酸式滴定管尖嘴处气泡的方法是快速放出液体,在滴定时,左手操作滴定管活塞,故答案为:检验是否漏水;标准液润洗;快速放出液体;左;
(6)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同=cmol/L×b×10-3L=bc×10-3mol;依据元素守恒得到:
则20ml溶液中含有的CuSO4•5H2O物质的量为bc×10-3mol;100ml溶液中含bc×10-3mol×5=5bc×10-3mol;
所以CuSO4•5H2O质量分数的表达式=$\frac{c×b×10{\;}^{-3}×250×5}{a}$;故答案为:$\frac{c×b×10{\;}^{-3}×250×5}{a}$;
(7)a.未干燥锥形瓶对实验结果无影响,故错误;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液读数偏小,结果偏低,故错误;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高,故正确;
d.读取滴定管中待测液的初始体积时仰视,读数偏小,则消耗滴定标准液偏高,所以结果偏高,故正确;
故答案为:cd.
点评 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案| A. |  | B. | CH≡CCH3 | C. | CH2=CHCH=CH2 | D. | CH3CH2C≡CCH3 |
| A. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | B. | 钠原子的电子式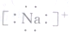 | ||
| C. | 硫原子的结构示意图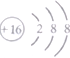 | D. | 铝离子的结构示意图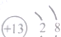 |
| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
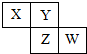 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Z单质与氢气反应较Y剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z强 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
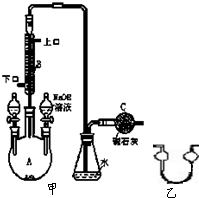 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: