题目内容
11.向27.2g Fe和Fe2O3的混合物中加入200mL稀硫酸,在标准状况下放出2.24L氢气向反应后的溶液中加入硫氰化钾溶液,未见颜色变化,为中和过量的硫酸,消耗2mol/L的氢氧化钠溶液100mL.求:(1)Fe和Fe2O3的物质的量.
(2)原稀硫酸的物质的量浓度.
分析 将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),据此计算n(H2SO4),再根据c=$\frac{n}{V}$计算.
解答 解:(1)只有铁和硫酸反应产生氢气,根据金属铁和氢气的量之间的关系:Fe~H2,在标准状况下放出2.24L即0.1mol氢气,金属铁的物质的量是0.1mol,质量是5.6g,所以氧化铁的质量是27.2g-5.6g=21.6g,物质的量是 $\frac{21.6g}{160g/mol}$=0.135mol,答:Fe和Fe2O3的物质的量是0.1mol;0.135mol;
(2)将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),故n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.1L×2mol/L=0.1mol,故c(H2SO4)=$\frac{0.1mol}{0.2L}$=0.5mol/L,答:原稀硫酸的物质的量浓度是0.5mol/L.
点评 本题考查混合物计算,难度中等,明确反应过程是解题关键,侧重考查学生分析思维能力,注意利用守恒法进行解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.3.2g某气态化合物甲在标准状况下的体积为1.12L,则甲的相对分子质量为( )
| A. | 40 g•mol-1 | B. | 22 g•mol-1 | C. | 64 | D. | 22 |
19.把碳-12原子质量假设为ng.若某原子质量为wg.则该原子的相对原子质量为( )
| A. | $\frac{12W}{n}$ | B. | $\frac{12n}{W}$ | C. | 6.02×1023W | D. | 12×6.02×1023W |
6.化学科学需要借助化学专用语言来描述.下列有关化学用语正确的是( )
| A. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | B. | 钠原子的电子式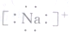 | ||
| C. | 硫原子的结构示意图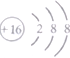 | D. | 铝离子的结构示意图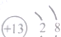 |
16.下列说法正确的是( )
| A. | SO2、CaO、CO均为酸性氧化物 | |
| B. | 硫酸钡和水都是弱电解质 | |
| C. | 向煮沸的1mol•L-1 NaOH溶液中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
3.美丽的“水立方”(Water Cube)是北京奥运会游泳馆,采用膜材料ETFE(四氟乙烯和乙烯的共聚物),为场馆带来更多的自然光.下列说法正确的是( )
| A. | ETFE的结构中,存在-CF2-CH2-CF2-CH2-连接方式 | |
| B. | 四氟乙烯与乙烯发生缩聚反应得到ETFE | |
| C. | 以乙烯为原料经过加成反应、取代反应可制得乙二醇 | |
| D. | ETFE材料是热固型(体形结构)的塑料 |
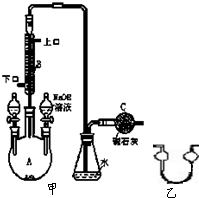 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: