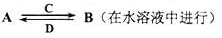题目内容
短周期元素X、Y、Z原子序数依次递增。X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族。
(1)Z元素在周期表中的位置是 。
(2)Y2ZX3溶液显 性,能证明该溶液中存在水解平衡的事实是 (填序号)。
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):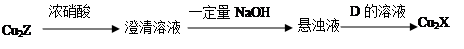
① D的化学式是 ;
② Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是 。
(4)某温度下,在一个5L的密闭容器中充入0.2 mol ZX2和0.1 mol X2,20 s后达到平衡,测得容器中含有0.18 mol ZX3,则用X2表示该反应的平均速率是v(X2) = ,此温度下该反应的化学平衡常数K= 。
26.(14分,每空2分)
(1)第3周期第ⅥA族
(2)碱 C
(3)①C6H12O6 ②Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
(4)9×10-4 mol/(L·S) 4.05×104 L/mol (不写单位不扣分)
解析试题分析:
(1)Z元素是硫元素,在周期表中的位置是第3周期第ⅥA族。Y是所在周期中金属性最强的,Y是钠元素,X是氧元素,
(2)Y2ZX3是Na2SO3溶液,强碱弱酸盐水解溶液呈碱性,当在此溶液中加入BaCl2溶液后,平衡逆向移动,碱性减弱,酚酞颜色变浅。
(3)① D是纤维素水解的最终产物应该是葡萄糖,化学式是C6H12O6 。
② Cu2X与浓硝酸反应有红棕色气体生成,红棕色气体是二氧化氮,说明发生了氧化还原反应,则化学反应方程式是Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O
(4)根据三态法计算模式:2SO2 + O2 2 SO3
2 SO3
开始(mol·L-1) 0.04 0.02 0
转化(mol·L-1) 0.036 0.018 0.036
平衡(mol·L-1) 0.004 0.002 0.036
v(X2) =0.018/20=9×10-4 mol/(L·S) 化学平衡常数K=0.0362/(0.0042 *0.002) = 4.05×104
考点:考查元素周期表中物质的推断,新情景下氧化还原方程式的书写,化学反应速率,化学平衡常数计算等知识。

X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g·mol-l | 32 | 34 | / |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为
 ,则X的化学式为 .
,则X的化学式为 .(2)Y的化学性质描述正确的是 。
a.不稳定性 b.弱碱性 c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH= 。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)= mol·L-1。
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
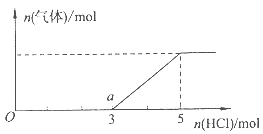
①O点溶液中所含溶质的化学式为 。
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是 。
同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
短周期元素X?Y?Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13?下列判断正确的是
| A.Y元素位于第2周期 | B.Y?Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ>HnX |
下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |