题目内容
X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平)。
按要求回答下列问题:
(1)X2、Y2可能的组合是__________________。
a.F2、Br2 b.I2、Cl2 c.C12、O2 d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:___________________[用(1)中所选的X2、Y2回答,下同]。判断HXO3+HX能否反应:___________(填“能”或“不能”)。若能反应,请写出其化学反应方程式,若不能反应,请说明理由:____________________。
(3)若用KX制取HX,不能选用浓硫酸的原因是________________________。(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______________________。
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量l mol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液。则生成的沉淀C的成份是(填化学式)____________________。E溶液中阳离子除H+外,另外的阳离子的检验方法是_______________________________________。
( 共11分)(1)b(1分)(2)Cl2>HIO3>I2 (1分)能(1分) HIO3 + 5HI=3I2 + 3H2O(2分)
(3) 2HI + H2SO4(浓)=SO2↑ + I2 + 2H2O (2分)
(4)ClO― + 2I― + 2H+=Cl― + I2 + H2O (2分)
(5)FeS 和 S (1分) ;取少量E 溶液滴入KSCN溶液时无现象,再向其中滴入氯水后溶液呈血红色,则E溶液中有Fe2+(1分)
解析试题分析:(1)a、单质氟是活泼的非金属,极易与水反应,所以a不正确;b、氯气的非金属性强于单质碘的,所以氯气与单质碘溶于水可以反应I2+Cl2+H2O→HIO3+HCl,b正确;c、氧气不溶于水,与氯气在水溶液中不反应,c不正确;d、氮气不溶于水,与单质溴不反应,d不正确,答案选b。
(2)在反应I2+Cl2+H2O→HIO3+HCl中,氯气是氧化剂,单质碘是还原剂,HIO3是氧化产物。根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,氧化性强弱顺序是Cl2>HIO3>I2;HIO3与HI中碘元素的化合价分别是+5价和-1价,所以二者能发生氧化还原反应生成单质碘,反应的化学方程式为HIO3 + 5HI=3I2 + 3H2O。
(3)HI具有还原性,浓硫酸具有氧化性,所以不能用浓硫酸与KI反应制备HI,反应的化学方程式为2HI + H2SO4(浓)=SO2↑ + I2 + 2H2O。
(4)ClO-具有强氧化性,能把I-氧化生成单质碘,反应的离子方程式为ClO― + 2I― + 2H+=Cl― + I2 + H2O。
(5)铁离子具有氧化性,能把碘离子氧化生成单质碘,反应的离子方程式为2Fe3++2I-=2Fe2++I2。S2-也具有还原性,能被Fe3+氧化生成单质S和氯化亚铁。又因为Na2S过量,所以还有FeS沉淀生成,即C是S和FeS的混合物。FeS与氢氧化钠溶液不反应,所以生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D应该是FeS。FeS与稀硫酸完全反应生成H2S和硫酸亚铁,即E溶液是硫酸亚铁。亚铁离子具有还原性,所以检验亚铁离子的方法是取少量E 溶液滴入KSCN溶液时无现象,再向其中滴入氯水后溶液呈血红色,则E溶液中有Fe2+。
考点:考查氧化还原反应的有关判断、应用;卤素单质及其化合物、铁化合物的性质以及亚铁离子的检验

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m

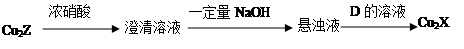
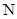
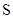
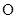
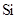
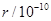 m
m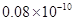 m B.
m B.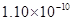 m C.
m C. m D.
m D.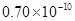 m
m