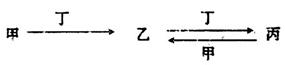题目内容
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系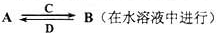
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式 ;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 . A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
(1)Na>Al>C>O>H(2) 乙醛 5CH3CHO+2MnO4-+6H+==5CH3COOH+2Mn2++3H2O (3) O=C=O ①AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3 H2O+CO2="2" Al(OH)3↓+CO32-
②CO32-+H2O HCO3-+OH-,c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+),NaCl,NaHCO3,CO2 。
HCO3-+OH-,c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+),NaCl,NaHCO3,CO2 。
解析试题分析:(1)根据题意可知这五种元素分别是:X:H; Y:C; Z:O; Q:Na; R:Al;对于电子层数相同的元素来说,元素的核电荷数越大,原子半径越小;对于电子层不同的元素来说,层数越多,原子半径越大。所以这五种元素的原子半径的大小顺序是:Na>Al>C>O>H.(2)X,Y,Z形成的既含极性键又含非极性键,且相对分子质量最小的物质是乙醛,它和酸性高锰酸钾溶液反应的离子方程式是:5CH3CHO+2MnO4-+6H+==5CH3COOH+2Mn2++3H2O。(3)C是CO2。其结构式是O=C=O①如果A,B均由三种元素组成,B为两性不溶物,则A是NaAlO2,B是Al(OH)3.由A转化为B的离子方程式AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2 AlO2-+3 H2O+CO2="2" Al(OH)3↓+CO32-.②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性则A是Na2CO3,B是NaHCO3. A溶液显碱性的原因是CO32-+H2O HCO3-+OH- A,B浓度均为0.1mol/L的混合溶液中,Na2CO3水解程度大于NaHCO3,所以c(HCO3-)> c(CO32-)。水解的溶液都显碱性,所以c(OH-) >c(H+),但盐水解的程度是很微弱的,所以c(CO32-) >c(OH-)。故混合溶液中离子浓度由大到小的顺序是c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+)。常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl,NaHCO3,CO2 。
HCO3-+OH- A,B浓度均为0.1mol/L的混合溶液中,Na2CO3水解程度大于NaHCO3,所以c(HCO3-)> c(CO32-)。水解的溶液都显碱性,所以c(OH-) >c(H+),但盐水解的程度是很微弱的,所以c(CO32-) >c(OH-)。故混合溶液中离子浓度由大到小的顺序是c(Na+) >c(HCO3-)> c(CO32-) >c(OH-) >c(H+)。常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有NaCl,NaHCO3,CO2 。
考点:考查元素、化合物的推断及化学性质和相互转化的知识。

 阅读快车系列答案
阅读快车系列答案有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。
对元素周期表和元素周期律的发现有突出贡献的科学家是
| A.拉瓦锡 | B.门捷列夫 | C.阿伏加德罗 | D.道尔顿 |