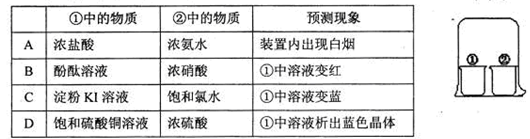
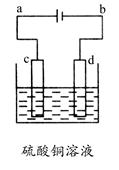
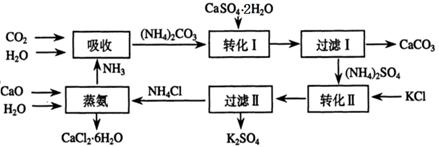
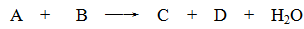题目内容
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g·mol-l | 32 | 34 | / |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为
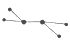 ,则X的化学式为 .
,则X的化学式为 .(2)Y的化学性质描述正确的是 。
a.不稳定性 b.弱碱性 c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH= 。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)= mol·L-1。
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
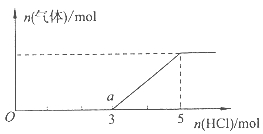
①O点溶液中所含溶质的化学式为 。
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是 。
(1)N2H4;(2)acd;(3)①1;②3.0×10-6mol·L-1;
(4)①Na2S和NaOH;②c(Na+)>c(Cl—)>c(HS—)>c(OH—)>c(H+)>c(S2-)。
解析试题分析:根据题意知,X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,X常用作火箭推进剂,结合X分子的结构模型判断,X为N2H4,Y分子中含有的原子个数为4,相对分子质量为34 ,则Y为H2O2;Z的化学式可用H2A表示,则Z为H2S。(1)根据上述分析知,X的化学式为N2H4;(2)Y为H2O2,化学性质为a.不稳定性c.氧化性 d.还原性,选acd;(3)Z为H2S,将一定量的H2S气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应生成硫化铜沉淀和硫酸。①反应后溶液中氢离子浓度为0.1mol·L-1,pH=1;②若反应后溶液中c(S2-)=2.0×10-30mol·L-1,根据Ksp(CuS)=c(Cu2+)c(S2-)=6.0×10-36计算,则溶液中c(Cu2+)=3.0×10-6mol·L-1;(4)根据题给图像结合反应Na2S+HCl==NaHS+NaCl,NaHS+HCl==NaCl+H2S分析知,①O点溶液中所含溶质的化学式为Na2S和NaOH;②由图像可知,a点溶液为NaCl和NaHS混合液且氯化钠的浓度大于硫氢化钠的浓度,溶液呈碱性,硫氢根离子的水解程度大于电离程度,该溶液中离子的物质的量浓度由大到小的顺序是c(Na+)>c(Cl—)>c(HS—)>c(OH—)>c(H+)>c(S2-)。
考点:考查物质推断及相关物质的性质、沉淀溶解平衡及化学反应图像、离子浓度大小比较。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。