题目内容
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3。时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:____________________________。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为_______________。充分反应后温度降至____________以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的____(填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式 ________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=_________________。
(共14分)(1)(1分)—467.5 (2)①3(2分);Cl2+SO32-+H2O=2Cl-+SO42-+2H+ (2分);
Al+FeCl3=Fe+AlCl3 (2分);315℃(1分) ② c (2分)
(3)(4分)O2+4e-+2H2O=4OH- (2分); 2:23(2分)
解析试题分析:(1)已知:①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol和②3CO(g)+ Fe2O3(s)
2Fe(s)+3CO(g) △H=-492.7kJ/mol和②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol,所以由盖斯定律可知,①+②即得到2Fe2O3(s)+3C(s)
2Fe(s)+3CO2(g) △H=+25.2kJ/mol,所以由盖斯定律可知,①+②即得到2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g),所以该反应的反应热△H=-492.7kJ/mol+25.2kJ/mol=-467.5kJ/mol。
4Fe(s)+3CO2(g),所以该反应的反应热△H=-492.7kJ/mol+25.2kJ/mol=-467.5kJ/mol。
(2)①根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应的化学方程式为A12O3+3C12+3C 2A1C13+3CO。反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol;Cl2有强氧化性,能将SO32-氧化为SO42-,自身被还原为C1-,因此反应离子方程式为SO32-+C12+H2O=SO42-+2C1-+2H+;由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3,反应的化学方程式为Al+FeCl3
2A1C13+3CO。反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol;Cl2有强氧化性,能将SO32-氧化为SO42-,自身被还原为C1-,因此反应离子方程式为SO32-+C12+H2O=SO42-+2C1-+2H+;由工艺流程可知,升华器中主要含有AlCl3和FeCl3,加入少量Al除去FeCl3,Al与FeCl3反应生成Fe、AlCl3,反应的化学方程式为Al+FeCl3 2A1C13+Fe;由题目信息可知,AlCl3的升华温度更低,应控制温度使AlCl3升华,且FeCl3不升华,所以温度应控制在315℃以下。
2A1C13+Fe;由题目信息可知,AlCl3的升华温度更低,应控制温度使AlCl3升华,且FeCl3不升华,所以温度应控制在315℃以下。
②AlCl3水解吸热,直接加热AlCl3?6H2O,水解彻底生成氢氧化铝,得不到氯化铝。浓硫酸吸水,同时可以生成HCl抑制氯化铝水解,利用浓硫酸的吸水性与难挥发性,即答案选c。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此该原电池实质是金属铝发生的吸氧腐蚀,氧气在正极放电生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;电量相同,则原电池转移电子相同。在反应中铝失去3个电子,铅失去2个电子。设转移电子为3mol,则n(Al)=3mol÷3=1mol、n(Pb)=3mol÷2=1.5mol,故m(Al):m(Pb)=1mol×27g/mol:1.5mol×207g/mol=2:23。
考点:考查反应热的计算;氧化还原反应方程式的书写以及有关计算;水解平衡;电化学原理的应用与计算等

 阅读快车系列答案
阅读快车系列答案(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。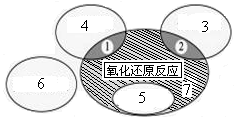
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3
 N2+6NH4Cl
N2+6NH4Cl①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)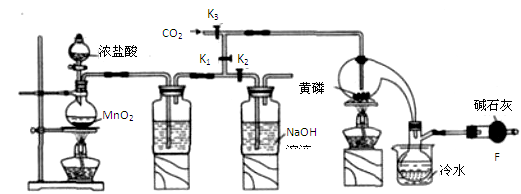
A B C D E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,
E中冷水的作用是
F中碱石灰的作用是_____
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40mL
已知:H3PO3+H2O+I2="=" H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
| A.K | B.Na | C.Fe | D.Al |
 ,找出其中一个变化与“
,找出其中一个变化与“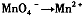 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。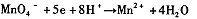
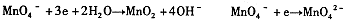 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。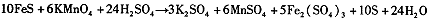
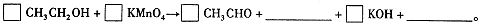

 , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、 KSP[Cu(OH)2]=2.0×10—20 、 lg5=0.7)